Асцит брюшной полости — симптомы и варианты лечения, прогноз для жизни Асцит (водянка живота) – состояние, характеризующееся скоплением свободной жидкости в брюшной полости (больше 25 мл), которая может быть как воспалительного (экссудат), так и не воспалительного (транссудат) характера. Заболевание проявляется увеличением окружности живота, нарушением дыхания, болью в брюшине, чувством тяжести и распирания.
Наиболее часто (в 80% случаев) асцит возникает на фоне цирроза печени, достигшего финальной стадии декомпенсации. Эта стадия характеризуется истощением ресурсов печени, серьезными нарушениями печеночного и брюшного кровообращения, то есть появлением благоприятных условий для накопления жидкости.
Причины возникновения
Причины асцитической болезни имеют неожиданный характер, самые распространенные среди них представлены ниже. Это:
- злокачественные новообразования и метастазы;
- цирроз печени и увеличение давления крови в портальной системе;
- тромбоз (сужение печеночных, нижней полой и воротной вен);
- острые и хронические воспалительные заболевания почек;
- нефротический сидром (с мочой начинает выводится белок);
- хроническая почечная недостаточность;
- воспалительное поражение серозной оболочки сердца;
- острая и хроническая сердечная недостаточность;
- некоторые инфекционные и воспалительные заболевания кишечника, при которых наблюдается диарея и потеря белка;
- воспаление поджелудочной железы;
- туберкулез;
- псевдомиксома (накопление слизи);
- анасрка.
Указанное заболевание является осложнением цирроза печени и не только. В организме прогрессирует постепенно, первое время никак себя не проявляет. Асцит брюшной полости сложно поддается успешному лечению. Однако исцеление наступает, если устранить основной патогенный фактор.
Диагностические исследования
Пациент обращается к врачу с характерными признаками протекания патологии в организме. После проведения визуального осмотра, пальпации живота, прослушивания при помощи фонендоскопа и сбора анамнеза, специалист назначает диагностическое обследование. Определить проблему доктору не составит труда, так как патология проявляется колебаниями «волны» при пальпации брюшины.
Для подтверждения диагноза назначаются следующие инструментальные методы:
- ультразвук для выявления повышенного скопления жидкости;
- лапароскопия для оценки изменений состояния внутренних органов;
- лапароцентез (делается прокол для выведения свободной воды);
- компьютерная томография;
- рентген органов груди;
- магнитно-резонансная томография;
- ангиография (если причина появления сосудистые проблемы).
В тяжелых случаях диагностика и лечение цирроза печени с асцитом осуществляется в условиях стационара. Назначается биохимический анализ крови, который позволяет определить уровень белка, креатина, мочевины и калия. После проведенного исследования на основе результатов протокола врач принимает решение по выбору той или иной тактики.
Симптомы асцита
Формирование асцита брюшной полости у большинства пациентов при онкологических заболеваниях происходит постепенно, в течение нескольких недель или даже месяцев. Поэтому первые признаки этого грозного осложнения остаются без внимания.
Клинически асцит начинает проявляться уже после того, как в брюшной полости скопится достаточно большое количество жидкости, проявляется это осложнение:
- Чувством распирания в животе.
- Разными по характеру и длительности абдоминальными болями.
- Отрыжкой и изжогой.
- Тошнотой.
Визуально обратить внимание можно на постепенно увеличивающийся живот, в вертикальном положении он свисает вниз, а в горизонтальном расплывается по бокам. Растягивание кожи брюшной стенки позволяет увидеть сеть кровеносных сосудов и выпячивающийся пупок.
Давление на грудную клетку вызывает одышку и перебои в работе сердца. При асците человеку трудно наклониться, застегнуть обувь, надеть брюки.
Возможные осложнения
Ответ на вопрос, сколько проживет пациент при асците на фоне цирроза печени, во многом зависит от своевременности обращения к врачу.
Заболевание само по себе является декомпенсацией, то есть осложнением уже имеющей патологии, поэтому отсутствие компетентной помощи часто приводит к смертельному исходу.
Возможными последствиями бывают:
- Появления кровотечений разной локализации.
- Развитие печеночной энцефалопатии.
- Тромбы в селезенке или в воротниковой вене.
- Воспалительные процессы в области брюшины.
- Гепотореанальный синдром.
Важно знать! Болезнь угрожает пациенту, поэтому обращение к врачу на первичной стадии крайне важно. Это позволит специалисту назначить необходимую терапию, исключить появления осложнений и увеличить продолжительность жизни.
Стадии
В зависимости от количества скопившегося экссудата выделяют три стадии асцита:
| Транзиторный | жидкости в брюшной полости не более 400 мл. На этой стадии может быть лишь вздутие живота. |
| Умеренный | выставляется, когда экссудата в брюшной полости не более 5 литров. На этой стадии осложнение проявляется клиническими симптомами в виде нарушения работы органов пищеварения, одышки. В случае отсутствия лечения асцита возможно развитие перитонита, дыхательной и сердечной недостаточности. |
| Напряженный | характеризуется скоплением до 20 литров жидкости. Состояние пациента тяжелое, значительно нарушается работа жизненно важных органов. |
Патогенетические подходы к диуретической терапии асцита у больных циррозом печени
Асцит — одно из самых значимых осложнений цирроза печени, которое возникает примерно у 40–50% пациентов за 10-летний период от постановки диагноза. Развитие асцита считают важным неблагоприятным прогностическим признаком прогрессии заболевания, так как он связан с50% смертностью втечение двух ближайших лет [23, 26].
До настоящего времени механизмы формирования асцита при циррозе печени остаются недостаточно ясными. Каким образом накапливается жидкость в брюшной полости, в чем физиологическая сущность данного процесса, какова его связь с центральной гемодинамикой, состоянием почек и брюшины? Почему именно данный синдром является поворотным в жизни пациентов с циррозом и независимо от этиологии заболевания определяет дальнейшую выживаемость и качество жизни этих больных?
Кроме того, прогрессивный рост фармакологического рынка почти не заметен в гепатологии. Тогда как в других областях медицины, например в кардиологии, ежегодно принимаются согласительные документы по лечению пациентов с сердечной недостаточностью (СН), куда включаются новые мочегонные препараты, оптимизируются схемы и подходы к терапии. Лечение отечно-асцитического синдрома у кардиологического больного четко отработано, тогда как обсуждение принципов курации гепатологического пациента влечет за собой целый ряд споров и разногласий.
Эти и многие другие вопросы уже сегодня требуют своего разрешения, прежде всего для врачей-специалистов, ежедневно участвующих в лечении больных хроническими заболеваниями печени.
Механизмы возникновения асцита у больных циррозом печени
Развитие асцита обусловлено повышенной лимфопродукцией в печени в связи с блокадой оттока из нее венозной крови, однако его возникновение начинается с момента повреждения гепатоцитов, т. е. с этапа гепатита.
Основными механизмами развития отечно-асцитического синдрома являются (
):
- нарушение функции печени (гепатопривный синдром);
- выброс вазодилятаторов и цитокинов поврежденными гепатоцитами;
- активация симпато-адреналовой (САС) и ренин-ангиотензин-альдестероновой системы (РААС) с последующим нарушением функции сердечно-сосудистой системы (ССС) и почек;
- формирование портальной гипертензии (ПГ): • вследствие активации клеток синусоидального компартмента с развитием функциональной ПГ; • активации процессов фиброгенеза в печени с нарушением ее сосудистого русла и развитием органической ПГ;
- блокада венозного и лимфатического оттока от печени.
Остановимся на более детальном рассмотрении данных положений.
Развитие синдрома печеночно-клеточной недостаточности (ПКН) у больных циррозом печени. Характеризуется:
- нарушением синтеза белков и развитием гипоальбуминемии, которая приводит к снижению онкотического давления плазмы крови, при этом усиливается выход жидкости из сосудистого русла, уменьшается объем внутрисосудистой жидкости, снижается наполнение центрального артериального русла (эффективный объем циркулирующей крови (ОЦК)), что компенсаторно повышает активность РААС и увеличивает уровень альдостерона, вызывающего задержку жидкости. Однако в условиях сохраняющейся патологии печени компенсаторный механизм (активация РААС) становится патологическим, способствуя дальнейшей задержке жидкости в организме, формированию асцита и отеков;
- нарушением детоксицирующей функции печени, что сопровождается расстройством катаболизма гормонов, увеличением содержания в крови эстрогенов, обладающих антидиуретическим действием и стимулирующих задержку жидкости и активацию РААС.
Выброс вазодилятаторов и цитокинов поврежденными гепатоцитами. Нарушение детоксицирующей функции печени, развитие ПКН и порто-кавального шунтирования способствуют проникновению в кровь из поврежденных гепатоцитов вазодилятаторов, таких как глюкагон, оксид азота, простагландин E2α, предсердный натрий-уретический гормон, вазоинтестинальный пептид, простациклин, что приводит к генерализованной вазодилятации и снижению общего периферического сопротивления сосудов (ОПС). При этом в эндотелии сосудов печени, под влиянием эндотоксинов и цитокинов, синтезируются мощные вазоконстрикторы, в частности эндотелин-1, что вызывает спазм сосудов. То есть происходит разобщение местного и общего кровотока, связанное с дисбалансом вазодилятирующих и вазоконстриктивных веществ, что приводит:
- к активации и трансформации синусоидальных клеток Ито в миофибробласты, которые сокращаются, сужают просвет синусоидов, формируя функциональную ПГ, вместе с клетками Купфера синтезируют коллаген и вазоактивные вещества, стимулирующие САС и РААС;
- к неадекватной периферической вазодилятации, вызывая компенсаторную активацию САС и РААС, повышение уровня антидиуретического гормона (АДГ).
Активация САС и РААС. Активированные САС и РААС воздействуют на основные мишени:
- ССС: следствием периферической вазодилятации является увеличение ОЦК, ударного объема (УО), минутного объема кровотока (МОК) и формирование гиперкинетического типа кровообращения. Гиперкинетическое состояние центральной гемодинамики первоначально имеет компенсаторный характер, направленный на увеличение центрального эффективного объема циркулирующей крови и внутрипеченочного кровотока, что препятствует снижению портального давления при развитии порто-системных коллатералей. Однако уже на ранних этапах такой тип гемодинамики приводит к функциональной перегрузке миокарда, способствуя развитию диастолической, а впоследствии и систолической его дисфункции, реализуя системные проявления заболевания в виде СН и асцита [20, 22, 24, 37];
Основными факторами поражения ССС при циррозе печени являются шунтирование крови с прямым токсическим воздействием на миокард биологически активных веществ (адреналина, гистамина, серотонина), дисметаболические расстройства, связанные с нарушением печеночных функций, вегетативные нарушения, длительная гиперактивация САС и РААС [7, 35, 38]. Совокупность нарушений обмена биологически активных веществ приводит к развитию так называемой метаболической кардиомиопатии с дилятацией полостей сердца и СН. Данное состояние усугубляется хронической функциональной перегрузкой сердца на фоне гиперкинетического типа кровообращения [2, 4, 6]. То есть при развитии заболевания печени развивается системная реакция, которая реализуется через вовлечение в процесс ССС, формируя аналогичные СН способы компенсации и декомпенсации с возникновением отечно-асцитического синдрома [11, 12, 34].
- Почки: снижением кровотока в корковом слое на фоне гипердинамического типа кровообращения, что приводит к сужению сосудов, высвобождению ренина и повышению уровня альдостерона. Компенсаторно для восстановления ОЦК эти системы стимулируют увеличение реабсорбции натрия и воды, вызывая переход жидкости в межклеточное пространство, что приводит к формированию асцита и отеков [5, 8].
Основными факторами поражения почек при циррозе печени являются:
- • снижение почечного кровотока и перфузии коркового вещества почек в результате шунтирования крови по анастомозам в субкортикальном слое;
- • уменьшение эффективного ОЦК;
- • повышение уровня вазоконстрикторов (эндотелина-1, тромбоксана и др.);
- • снижение синтеза простагландинов и калликреина почками, оказывающих сосудорасширяющее действие.
Поражение почек развивается вследствие нарушения баланса между системной вазодилятацией и почечной вазоконстрикцией. Несмотря на характерную для цирроза печени системную вазодилятацию, в почках, как и в печени, происходит вазоконстрикция, что приводит к снижению скорости клубочковой фильтрации, уровень ренина в плазме при этом возрастает. Натрий компенсаторно усиленно реабсорбируется в почечных канальцах, что вызывает повышение осмолярности мочи. Происходит накопление жидкости в организме, несмотря на нормальный объем мочи, малосолевую диету и диуретическую терапию. Во внепочечных сосудах преобладает расширение артерий, и в результате снижается ОПС с развитием артериальной гипотензии. Сердечный выброс не изменяется или даже повышен, однако эффективный почечный кровоток уменьшается в результате перераспределения кровотока в селезенку, кожу и другие органы, таким образом происходит шунтирование коркового слоя почек. Наиболее ранним признаком включения почечного механизма при развитии асцита у больных циррозом печени является задержка натрия в организме, что проявляется снижением суточной экскреции натрия с мочой менее 78 ммоль/сут [8, 16].
Задержка натрия почками — это одна из вероятных причин асцита, предшествующая накоплению асцитической жидкости. На ранних этапах она является результатом блокады венозного оттока из печени и первичной вазодилятации.
Формирование ПГ. Развитие мощного дисбаланса вазоактивных веществ, вызывающего спазм синусоидов, а также способствующего активному фиброгенезу в печени, с формированием цирротических узлов, приводят к нарушению венозного русла печени и развитию ПГ.
Обратимость асцита определяется стадией ПГ. Асцит потенциально обратим, если имеется функциональная ПГ, и необратим, если произошли изменения сосудистого русла печени и сформировалась органическая ПГ [1, 11].
Функциональная (синусоидальная) ПГ определяется [19, 23, 38]:
- вегетативным тонусом;
- сокращением клеток Ито и, как следствие, сужением просвета синусоидов и выделением ими вазоактивных веществ, стимулирующих САС и РААС;
- тонусом печеночных сосудов, регулируемым вазоактивными субстанциями;
- реологическими свойствами крови всосудах портальной системы.
Органическая ПГ формируется на фоне нарушения цитоархитектоники печени, она определяется [23]:
- сдавлением и деструкцией синусоидов;
- портопеченочными шунтами;
- разрастанием соединительной ткани в центролобулярных зонах долек.
При этом важно отметить, что даже на этапе органической ПГ сохраняется ее функциональный компонент, который можно уменьшить, используя медикаментозную терапию, направленную на коррекцию состояния САС, РААС, реологию крови и другие патогенетические звенья.
Блокада венозного и лимфатического оттока от печени. Повышенное давление в портальной системе приводит к нарушению венозного оттока из печени и непарных органов брюшной полости, что сопровождается переполнением синусоидов, усилением продукции лимфы в печени.
У больных циррозом печени объем суточного лимфооттока через грудной лимфатический проток может увеличиваться до 20 литров. Лимфа из сосудов печени и непарных органов пропотевает в брюшную полость, формирует асцит, устанавливая динамическое равновесие с процессом всасывания ее в кишечные капилляры.
Таким образом, условно можно выделить несколько уровней формирования асцита, тесно взаимосвязанных между собой:
- гуморальный-метаболический, определяемый дисбалансом вазоактивных субстанций (вазодилятаторов и вазоконстрикторов), гипоальбуминемией, дисэлектролитными нарушениями, гиперэстогенемией, ростом АДГ;
- клеточный, определяемый специфическим реагированием клеток печени (гепатоцитов, эндотелиоцитов, клеток Купфера, Ито) и брюшины (мезотелиоцитов);
- органный, определяемый исходным состоянием, вовлечением в процесс и специфическим реагированием органов-мишеней (собственно печени, ССС, почек);
- системный, определяемый характером нейроэндокринного реагирования САС, РААС и системной реализацией ПГ.
При этом обратимость указанных изменений зависит от стадии ПГ (функциональной или органической).
Классификация асцита
В зависимости от количества асцитической жидкости и эффективности терапии выделяют:
- начальный или транзиторный (до 400 мл, выявляется при ультразвуковом исследовании);
- умеренный (когда асцит не напряжен и хорошо поддается терапии);
- выраженный или напряженный асцит;
- резистентный асцит (вариант напряженного асцита, резистентного клечению).
Критериями резистентного (рефрактерного) асцита являются отсутствие снижения или снижение массы тела менее 200 г/сут у больного в течение 7 дней на фоне низкосолевой диеты (5,2 г поваренной соли в сутки) и интенсивной диуретической терапии (спиронолактон по 400 мг/сут и фуросемид по 160 мг/сут), а также уменьшение экскреции натрия с мочой менее 78 ммоль в сутки [16, 25]. О резистентном асците говорят также в тех случаях, когда он не уменьшается или быстро рецидивирует после парацентеза или осложнения диуретической терапии не позволяют назначать диуретики в эффективных дозах. В практике критерии резистентного асцита выявляются менее чем у 10% пациентов с циррозом печени.
Причинами резистентного асцита, как правило, являются:
- избыточный прием натрия и жидкости;
- неадекватная мочегонная терапия;
- гипотония;
- алкалоз;
- гипокалиемия, гипонатриемия, гипоальбуминемия;
- прием нестероидных противовоспалительных средств;
- прогрессирование заболевания печени;
- синдром Бадда–Киари;
- канцероматоз брюшины;
- спонтанный бактериальный перитонит (СБП).
Многие причины рефрактерности асцита являются потенциально обратимыми, поэтому своевременное их устранение может значительно повысить эффективность проводимой терапии.
Лечение асцита у больных циррозом печени
Следует отметить, что сама по себе задача терапии асцита у больных циррозом печени труднее, чем лечение других форм накопления жидкости в организме, потому что формирование отечно-асцитического синдрома является проявлением значительной декомпенсации заболевания. По результатам контролируемых исследований появление асцита значительно ухудшает качество жизни и увеличивает риск развития фатальных осложнений цирроза печени [27, 39], поэтому его терапия представляет собой одну из важнейших составляющих успешного лечения этих больных. Однако, с учетом того, что в развитии асцита задействованы сложные нейрогормональные механизмы, бездумная дегидратация может вызвать лишь побочные эффекты и «рикошетную» задержку жидкости.
Режим, диета и потребление жидкости больными циррозом печени и асцитом. У пациентов с асцитом, не ограничивающих потребление соли с пищей, суточная экскреция натрия с мочой снижена до 78 ммоль и менее, при этом внепочечные потери натрия могут достигать 10 ммоль/сут.
Употребление больными циррозом печени натрия более 90 ммоль/сут ведет к развитию асцита, так как каждый грамм натрия задерживает до 200 мл жидкости. Поэтому с пищей в течение суток рекомендуется употреблять не более 90 ммоль натрия (5,2 г поваренной соли), в сочетании с ограничением до 1 литра в сутки количества жидкости. При этом важно учитывать, что ограничение жидкости не показано больным с низким содержанием Nа в сыворотке крови (менее 120 ммоль/л) [16].
На сегодняшний день не опубликовано исследований, которые демонстрировали бы положительное или отрицательное влияние ограничения воды на разрешение асцита. Большинство экспертов считают, что у больных с неосложненным асцитом роль ограничения воды отсутствует. Несмотря на это во многих центрах диета с ограничением воды у пациентов с асцитом и гипонатриемией стала стандартом клинической практики. В этом вопросе существует много противоречий, и лучший подход пока не найден. Как правило, гепатологи лечат таких больных со строгим ограничением воды. С точки зрения патогенеза гипонатриемии, такое лечение является алогичным и может ухудшить тяжесть центральной гиповолемии, которая запускает неосмотическую секрецию АДГ. Еще большее повышение концентрации циркулирующего АДГ ведет к дальнейшему снижению почечной функции. Нарушенный клиренс свободной воды имеют 25–60% пациентов с цирротическим асцитом, при этом у них часто развивается спонтанная гипонатриемия.
Погрешности в диете часто служат причиной плохо поддающегося лечению (резистентного, рефрактерного) асцита. При употреблении большого количества соли применение современных мочегонных препаратов даже в высоких дозах окажется неэффективным.
Диета должна быть по существу вегетарианской, так как большинство продуктов с высоким содержанием белка (мясо, яйца и молочные продукты) содержат много натрия, поэтому в связи с этим рацион нужно дополнять белковой пищей с низким содержанием натрия. Рекомендуется употреблять бессолевой хлеб, масло и все блюда готовить без добавления соли. Показаны также продукты, богатые калием и микроэлементами. Энергетическая ценность диеты должна составлять ~1500–2000 ккал с содержанием 70 г белка и 90 ммоль натрия в сутки.
Пациенту с асцитом рекомендуется ограничение физической активности, что способствует уменьшению количества метаболитов, образующихся в печени. Также в положении лежа несколько усиливается портальный венозный и почечный кровоток.
Общие подходы к терапии асцита у больных циррозом печени. Стратегические направления терапии асцита включают ограничение соли в пище и медикаментозное выведение избыточной жидкости из организма. Кроме этого, исходя из рассмотренных позиций патогенеза асцита у больных циррозом печени, важно решить терапевтические задачи по коррекции ПГ, ПКН, блокированию периферических вазодилятаторов, подавлению активности САС и РААС, нормализации функции ССС, почек и т. д.
Для безопасного медикаментозного выведения жидкости из организма необходимо соблюдение трех этапов:
- Избыточная жидкость должна быть переведена из внеклеточного пространства в сосудистое русло.
- Избыточная жидкость должна быть доставлена к почкам, где обеспечится ее фильтрация.
- При попадании первичной мочи в почечные канальцы должна быть блокирована реабсорбция, это обеспечит выведение избыточной жидкости из организма [13].
Для перевода избыточной жидкости из внеклеточного пространства в сосудистое русло используются:
- активные мочегонные средства (диуретики), которые за счет снижения ОЦК и гидростатического давления облегчают переход жидкости из внеклеточного пространства в сосудистое русло;
- гемодинамически активные нейрогормональные модуляторы: бета-блокаторы, ингибиторы ангиотензин-превращающего фермента (ИАПФ), антагонисты рецепторов ангиотензина (АРА) [4, 16];
- средства, повышающие в крови онкотическое (препараты плазмы крови и альбумина) и осмотическое давление (антагонисты альдостерона, усиливающие ионообмен и уменьшающие выраженность гипонатриемии разведения).
Наиболее оптимальными бета-блокаторами у пациентов с заболеваниями печени, эффективность которых подтверждена результатами метаанализа, являются неселективные производные группы пропранолола — Анаприлин в индивидуально подобранной дозе — 40–80 мг/сут или карведилол в индивидуальной дозе — 25–50 мг/сут [3, 14, 28, 31].
Среди ИАПФ у больных циррозом печени препаратами выбора является группа лизиноприла в индивидуально подобранной (2,5–20 мг/сут) дозе или препарат с двойным путем выведения спираприл по 6 мг/сут.
В отличие от других представителей этого класса они являются готовой лекарственной формой, а их эффективность подтверждена результатами сравнительных исследований [11, 17].
Из АРА у данной категории пациентов может использоваться эпросартан в индивидуально подобранной дозе — 300–600 мг/сут. В открытых исследованиях продемонстрирована эффективность препаратов данной группы у больных циррозом печени [32, 40].
Для доставки избыточной жидкости к почкам применяют положительные инотропные средства:
- сердечные гликозиды, критерием назначения которых у больных циррозом печени является наличие нормальной или пониженной фракции выброса (ФВ) (ввиду изначального гиперкинетического состояния центральной гемодинамики у этих пациентов с повышенным сердечным выбросом) при ЭХО-КГ, а также мерцательная аритмия;
- Неотон (с целью метаболической поддержки миокарда).
Для улучшения почечной фильтрации рекомендованы:
- допамин (лучше при артериальной гипотензии, за счет влияния на допаминергические рецепторы этот препарат увеличивает долю почечного кровотока);
- Эуфиллин (при уровне систолического артериального давления (САД) выше 100 мм рт. ст.).
Для блокады реабсорбции первичной мочи в почечных канальцах применяются собственно диуретики (преимущественно петлевые диуретики и антагонисты альдостерона).
Диуретическая терапия больных циррозом печени с асцитом. Принимая во внимание сложный патогенез развития отечно-асцитического синдрома, при его терапии используют диуретики различных фармакологических групп: антагонисты рецепторов альдостерона, калийсберегающие, петлевые, тиазидные диуретики и ингибиторы карбоангидразы. Алгоритм назначения диуретиков больным циррозом печени представлен на схеме 1.
Действие диуретиков при циррозе печени и асците носит многогранный характер и состоит в их влиянии на почечные структуры и внепочечные механизмы регуляции водно-электролитного баланса [9, 10], включая воздействие на уровне:
- клеточных мембран — диуретики регулируют их проницаемость, функции внутриклеточных белков-переносчиков и электрохимические процессы ионного транспорта;
- отдельного нефрона — влияние на фильтрационную загрузку нефрона, транспортную функцию различных его сегментов;
- почек — влияние на внутрипочечную гемодинамику, межнефронные взаимоотношения, активность тканевых составляющих нейрогуморальных систем;
- системной гемодинамики и водно-электролитного баланса.
Основным принципом разгрузочной терапии отечно-асцитического синдрома у больных циррозом печени является получение постепенно развивающегося и стабильного диуретического эффекта, при этом препаратом выбора является спиронолактон [15, 23].
В случаях рефрактерности к терапии антагонистами альдостерона перед назначением других диуретиков, действующих на иных участках нефрона, целесообразно оценить показания для использования дополнительных терапевтических мероприятий, в частности для введения альбумина и кровезамещающих коллоидных растворов.
При выраженном отечно-асцитическом синдроме объем диуретической терапии может быть расширен за счет петлевых или тиазидных диретиков, подавляющих реабсорбцию натрия и воды.
Рекомендуется комбинированное назначение калийвыводящих и калийсберегающих диуретиков, что способствует снижению риска возникновения электролитных нарушений [18, 21, 29].
Дозировку и частоту приема препарата подбирают индивидуально каждому больному. При поступлении пациента в стационар рекомендуется определить суточную экскрецию натрия, что облегчает подбор диуретика и контроль за эффектом лечения [16].
При начальных признаках асцита терапия начинается одним из препаратов группы калийсберегающих диуретиков, обычно спиронолактоном. В случае неэффективности добавляют петлевой диуретик.
Наличие признаков выраженного асцита требует изначального применения комбинированной терапии, при этом спиронолактон назначается в качестве надежного партнера петлевых диуретиков.
У больных циррозом печени с умеренной и выраженной ПГ возможно начало лечения курсами антагонистов альдостерона еще до формирования асцита в минимальных (25–50 мг/сут), не изменяющих диурез, дозировках в качестве нейрогуморального модулятора, однако данная точка зрения является авторской и не подтверждена широкими клиническими испытаниями.
При декомпенсации цирроза печени (в виде развития асцита) применение спиронолактона абсолютно необходимо и можно не бояться его сочетания с ИАПФ или АРА, если параллельно правильно использовать активные диуретики в достижении положительного диуреза. Препарат принимают в высоких дозах (100–300 мг, назначаемых однократно утром или в два приема утром и в обед) на период 1–3 недели до достижения компенсации. После этого доза спиронолактона должна быть уменьшена.
Нужно помнить, что концентрация спиронолактона в плазме крови выходит на плато к третьему дню лечения и после отмены (или уменьшения дозы препарата) его концентрация и действие пропадает (снижается) через трое суток. После достижения компенсации применение высоких доз спироналактона прекращается и рассматривается вопрос о назначении малых доз препарата в качестве дополнительного нейрогормонального модулятора.
Для длительной поддерживающей терапии больных циррозом печени рекомендуется использование малых (25–50 мг) доз спиронолактона дополнительно к ИАПФ и бета-адрено-блокаторам (БАБ), позволяющее более полно блокировать РААС и САС.
В случаях, когда необходима замена спиронолактона, препаратом выбора является амилорид по 10–15 мг/сут.
Оптимальное соотношение спиронолактона и фуросемида 5:2, например 100 мг спиронолактона и 40 мг фуросемида и т. д. Максимальные суточные дозы этих препаратов составляют 400 и 160 мг соответственно.
Фуросемид, в свою очередь, может быть неэффективен при выраженном гиперальдостеронизме, когда натрий, не реабсорбированный в петле Генле, всасывается в дистальном отделе нефрона. Вторая причина — гипокалиемия и алкалоз.
Альтернативными, в случаях неэффективности, фуросемиду петлевыми диуретиками для лечения асцита у больных циррозом печени могут рассматриваться: Урегит (этакриновая кислота) 25–50 мг/сут и буметанид, который не слабее фуросемида и применяется в дозах от 0,5 до 10 мг, что позволяет достичь оптимального диуреза.
Этакриновая кислота и тиазиды, как диуретики длительного действия, менее показаны больным циррозом печени, поскольку они способны усугублять развившиеся электролитные нарушения, и даже после их отмены могут продолжаться потеря калия с мочой и нарастание алкалоза.
Поэтому, в частности, тиазиды применяются преимущественно на этапе поддерживающей терапии и/или невозможности использовать спиронолактон. Принимая во внимания возможные побочные эффекты, тиазидные диуретики у больных циррозом печени назначают курсом не более 7–14 дней с перерывом на 3–4 дня.
Кроме вышеперечисленных, в 2006 году в России был зарегистрирован один из самых эффективных и безопасных петлевых диуретиков — торасемид (Диувер). Его стартовая доза составляет 5–10 мг, а при необходимости она может быть увеличена до 20 мг в сутки. Торасемид обладает не только более выраженным, чем фуросемид, мочегонным эффектом, но и имеет собственную активность в отношении рецепторов к альдостерону, что обеспечивает ему калийсберегающий эффект. Преимуществом является отсутствие нежелательных эффектов антагонистов альдостерона (гиперкалиемия, гирсутизм и другие), препарат обладает высокой биодоступностью (80% против 50% у фуросемида), пролонгированным эффектом (период полувыведения 3–5 часов против 1 часа у фуросемида) и мягким гипотензивным действием. Фармакокинетика торасемида мало зависит от функции почек и состояния кишечника, что обеспечивает низкий риск кумуляции препарата и меньшую, по сравнению с фуросемидом, экскрецию калия, кальция, неорганических фосфатов и магния.
При лечении отечно-асцитического синдрома у больных циррозом печени возможно использовать торасемид как в качестве монотерапии, так и в сочетании с Верошпироном. Терапия торасемидом показана при декомпенсации асцита, а также в целях профилактики его возникновения в дозировках 5–20 мг, не вызывающих гипокалиемии даже при длительном приеме. Рекомендуется использовать ступенчатый подход, начиная с 5 мг/сут, увеличивать дозу на 5 мг каждые 2–3 дня до достижения эффекта. На амбулаторном этапе не рекомендуется превышать суточную дозу 20 мг, так как большее количество препарата требует частого контроля уровня калия.
Для оценки эффективности мочегонной терапии у пациентов с циррозом печени и асцитом был проведен ряд сравнительных исследований торасемида и фуросемида. Так, в двойном слепом перекрестном исследовании были сопоставлены результаты однократного приема фуросемида (80 мг) и торасемида (20 мг) внутрь у 14 больных. Торасемид превосходил фуросемид по диуретической и натрийуретической активности. У 5 пациентов наблюдался слабый ответ на прием фуросемида, при этом торасемид вызвал значительное увеличение натрийуреза и диуреза [30, 33, 36].
Аналогично в двойном слепом рандомизированном исследовании у 28 пациентов с асцитом, получавших спиронолактон (200 мг/сут), были сопоставлены результаты 6-недельной терапии торасемидом (20 мг/сут) и фуросемидом (50 мг/сут). Оба препарата оказывали сопоставимое влияние на массу тела, диурез и экскрецию мочевой кислоты, натрия и хлоридов, однако в группе торасемида экскреция калия, кальция, неорганических фосфатов и магния была ниже [30, 33, 36].
В группе из 46 больных циррозом печени, осложнившимся асцитом (рандомизированное исследование), проводили лечение торасемидом 20 мг/сут или фуросемидом 40 мг/сут в сочетании со спиронолактоном 200 мг/сут. Если не удавалось добиться снижения массы тела на 300 г/сут, дозы диуретиков каждые 3 дня увеличивали до 40, 120 и 400 мг/сут соответственно. Торасемид вызывал более выраженное увеличение диуреза, чем фуросемид, хотя в целом результаты лечения в 2 группах оказались сопоставимыми. Увеличение доз диуретиков потребовалось у 2 больных группы торасемида и у 9 пациентов группы фуросемида [33, 36].
То есть по результатам исследований торасемид может рассматриваться как альтернатива комбинированной терапии Фуросемид + Верошпирон у больных циррозом печени и асцитом.
Ингибиторы карбоангидразы не нашли широкого применения у пациентов с асцитом, так как подавление ими реабсорбции натрия и воды в проксимальном канальце компенсируется усилением ее в дистально расположенных сегментах канальцев.
Препараты этой группы могут использоваться в качестве вспомогательного средства на фоне приема активных мочегонных (петлевых и/или тиазидных). Ингибиторы карбоангидразы блокируют фермент в области проксимальных почечных канальцев, что сопровождается незначительным диурезом (прирост до 10–15%), однако при этом усиливается «загрузка» натрием нижележащих отделов канальцев, что повышает эффективность более сильных диуретиков. При истощении фермента карбоангидразы через 3–4 дня непрерывного применения активность ацетазоламида падает, что требует перерыва в лечении.
Поэтому ацетазоламид (Диакарб) рекомендуется в дозе по 0,25 г трижды в день в течение 3–4 дней с двухнедельным перерывом. Данная терапевтическая тактика способствует подкислению среды, восстанавливает диуретическую активность тиазидных и петлевых диуретиков, при длительном применении которых развивается алкалоз. При сочетании с Эуфиллином мочегонный эффект Диакарба увеличивается.
Для избежания развития рефрактерности и побочного действия диуретиков на пациентов с асцитом важно оценивать эффективность лечения и проводить клинико-лабораторный скрининг с определением показаний для последующей коррекции режима дозирования или отмены препаратов.
Продолжение статьи читайте в следующем номере.
С. Н. Мехтиев, доктор медицинских наук, профессор Ю. А. Кравчук, кандидат медицинских наук И. В. Субботина О. А. Мехтиева * М. В. Шаповалов ВМА им. С. М. Кирова, *СПб ГМА им. И. И. Мечникова, Санкт-Петербург
Диагностика
Водянка живота может быть диагностирована врачом даже без применения специального оборудования – достаточно прощупать брюшную полость больного. Если при прощупывании врач обнаружит тупость в животе сбоку, при этом посередине обнаружится тимпанит, пациент болен асцитом.
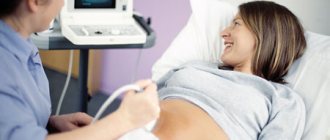
Для проведения более глубокой диагностики требуется провести УЗИ в полости брюшины, исследовать печень, а также сделать пункцию брюшины (парацентез). Взятие жидкости на анализ позволяет выявить стадию заболевания и определить его лечение. Парацентез проводится для выяснения причин болезни. Также парацентез может быть сделан в случае возникновения трудностей с дыханием и возникновения болей.
Кроме вышеперечисленных методов диагностики, пациент должен сдать анализы мочи, крови, а также пройти исследования иммунологического типа. От того, сколько информации врачу дадут полученные анализы, зависит возможность назначения дополнительных анализов и тестов.
Выводы
Прогноз относительно здоровья и жизни больного, у которого развился асцит при сердечной недостаточности, можно улучшить, приняв активные терапевтические действия. Однако, несмотря на достижения современной медицины, он остается неблагоприятным. Наличие сопутствующей патологии, возраст, сложные нарушения сердечного ритма, высокая артериальная гипертензия и наличие выпота в плевральной полости, говорят о том, что летальный исход неизбежен. В таком случае важно обеспечить достойное завершение жизненного пути и облегчить страдания больному.
Лечение асцита брюшной полости
Асцит брюшной полости, развивающийся как осложнение онкологического заболевания, следует лечить совместно с основной болезнью.
- Важно также начать устранение избытка лишней жидкости в первые две недели ее образования, так как затягивание терапии приводит к развитию массы осложнений. Излишняя жидкость может быть удалена при помощи прокола и ее откачивания – лапароцентезе, путем приема мочегонных средств.
- Соблюдение специальной диеты поможет снизить внутрибрюшное давление, уменьшит вероятность дальнейшего продуцирования чрезмерного экссудата.
Химиотерапия эффективна только в том случае, если асцит спровоцирован раком кишечника. При раке желудка, яичников и матки использование химиопрепаратов не дает выраженного положительного результата.
Описание препарата и состав
Препарат Верошпирон является калийсберегающим диуретиком , и обладает выраженным и длительным мочегонным действием. Активным действующим компонентом этого лекарственного средства является спиронолактон (один из гормонов коры надпочечников). Это вещество обладает длительным действием и способно препятствовать задержке воды и натрия в нижних отделах почечных канальцев. Верошпирон не оказывает существенного влияния на кровообращение в почках, способствует снижению кислотности мочи и уменьшает выведение калия из организма.
Мочегонный эффект данного препарата способствует снижению артериального давления. Он начинает проявляться через 2-5 дней после начала приема Верошпирона, и сохраняется на протяжении 3 дней после его отмены. После приема внутрь спиронолактон полностью всасывается из пищеварительного тракта в кровь и поступает в почки, оказывая мочегонное действие. Препарат выводится из организма преимущественно с мочой и частично с каловыми массами.
Медикаментозное лечение
Основными препаратами, помогающими выводить лишнюю жидкость из организма, являются диуретики. Благодаря их приему удается добиться перехода лишней жидкости из брюшной полости в кровяное русло, что способствует уменьшению симптомов асцита.
- Для начала пациентам назначают самую маленькую дозу диуретиков, чтобы минимизировать риск развития побочных эффектов. Важный принцип лечения мочегонными препаратами – это медленное нарастание диуреза, который не будет приводить к значительным потерям калия и иных важнейших метаболитов. Чаще всего рекомендуют прием препаратов Альдактон, Верошпирон, Триамтерен, Амилорид. Параллельно назначают препараты калия. Одновременно в схему лечения вводят гепатопротекторы.
- При этом врачи осуществляют ежесуточный контроль диуреза больного и при неэффективности лечения дозу препаратов увеличивают, либо заменяют их на более сильные средства, например, на Триампур или на Дихлотиазид.
Кроме мочегонных препаратов пациентам назначают средства, направленные на укрепление стенок сосудов (витамин С, витамин Р, Диосмин), препараты, препятствующие выходу жидкости за пределы сосудистого русла (Реополиглюкин). Улучшает обмен печеночных клеток введение белковых препаратов. Чаще всего для этой цели применяют концентрированную плазму, либо раствор Альбумина в 20%-ой концентрации.
Антибактериальные препараты назначают в том случае, если асцит имеет бактериальную природу. [adsen]
Народные средства
Комплексная терапия часто дополняется лекарственными травами и растениями. Они позволяют снизить проявление неприятной симптоматики, и способствуют быстрому выздоровлению. Хорошо себя зарекомендовали следующие средства:
- Отвар из петрушки. Его готовят из свежих листьев, которые заливают кипятком и настаивают в течение получаса. Принимать средство необходимо по полстакана каждый час в первой половине дня. Трех дней достаточно для облегчения состояния.
- Шелуха фасоли. Основной ингредиент кипятится минут 10, после чего вода сливается и настаивается. Достаточно 20 минут. Принимать полученное средство необходимо утром, следующий раз – за полчаса до завтрака, и столько же за 30 минут до обеда. Последний прием планируется на 8 вечера.
Самостоятельно вылечить болезнь нельзя. Поэтому народная медицина задействуется только вместе с обычными лекарствами. Для исключения появления побочных эффектов, перед приемом стоит проконсультироваться с врачом.
Лапароцентез брюшной полости
При асците лапароцентез брюшной полости является хирургической манипуляцией, при которой жидкость из брюшной полости удаляют пункционно. За один раз не следует откачивать более 4 литров экссудата, так как это грозит развитием коллапса.
Чем чаще осуществляют пункцию при асците, тем выше риск развития воспаления брюшины. Кроме того, повышается вероятность формирования спаек и осложнений от проводимой процедуры. Поэтому при массивных асцитах предпочтительнее установка катетера.
Показаниями к проведению лапароцентеза является напряженный и рефрактерный асцит. Жидкость может быть откачана с помощью катетера, либо она просто свободно вытекает в заранее подготовленную посуду, после установки в брюшную полость троакара.
Лекарственное взаимодействие Верошпирона
При назначении Верошпирона следует сообщить врачу о приеме других лекарственных средств, т. к. этот препарат способен взаимодействовать со многими из них.
Верошпирон:
- снижает эффективность антикоагулянтов (производных кумарина, Гепарина, Индандиона);
- снижает токсичность сердечных гликозидов (Строфантин К, Дигитоксин, Целанид, Коргликон и др.);
- снижает сосудистую чувствительность к Норэпинефрину;
- снижает эффективность Митотана;
- усиливает эффективность гипотензивных и мочегонных препаратов;
- усиливает метаболизм Феназола;
- усиливает токсичность литийсодержащих препаратов;
- ускоряет выведение Карбеноксолона, и их совместный прием приводит к задержке натрия;
- усиливает эффект Бусерелина, Трипторелина и Гонадорелина;
- при одновременном приеме с салицилатами уменьшается мочегонный эффект препарата;
- при приеме с калийсберегающими мочегонными или калийсодержащими препаратами, Индометацином, блокаторами альдостерона, антагонистами ангиотензина II и циклоспоринами появляется риск развития гиперкалиемии;
- при приеме с Колестирамином и хлоридом аммония повышается риск развития ацидоза;
- при приеме с нестероидными противовоспалительными средствами появляется риск развития гиперкалиемии;
- при приеме с Флудрокортизоном развивается усиление секреции калия в почечных канальцах; совместный прием с Дигоксином может приводить к замедлению выведения последнего и вызвать его токсичное воздействие на организм.
Перитонеовенозное шунтирование (шунт Левина)
Порой применяется для лечения рефрактерного асцита т.е. того, который не поддается медикаментозной терапии и быстро возвращается после пункции. Операция заключается в увеличении объема циркулирующей крови путем постоянного поступления жидкости из брюшной полости в общую систему кровотока.
Шунт Левина – это длинная пластиковая трубка, устанавливающаяся в абдоминальную полость, достигая тазового дна. Далее шунт соединяют с клапаном и силиконовой трубкой, которая подкожно проходит к области шеи для последующего подключения с внутренней яремной и верхней полой веной. Клапан открывается с помощью образующейся силы смещения диафрагмы и увеличения внутрибрюшного давления. Таким образом, происходит беспрепятственное поступление жидкости в верхнюю полую вену.
Диета
Предусматривает уменьшение употребления жидкости, а также соли по причине того, что она задерживает в организме жидкость. Врачи советуют диету по Авиценне. Такая диета при асците предусматривает практически полный отказ от жирной пищи, употребление орехов в большом количестве, отказ от свежих фруктов в пользу сухих.
Также жидкую пищу (борщ, суп) следует заменить бульоном с добавками в виде сельдерея, петрушки, фенхеля. Диета при асците не регламентирует, сколько мяса должен употреблять больной, однако все мясо должно быть нежирного типа (курица, индейка, кролик).
Сколько живут люди с асцитом?
Срок жизни людей с диагностированным асцитом варьирует в широких пределах, что зависит от целого ряда факторов. Продолжительность жизни пациента с асцитом обусловлена:
- Временем начала лечения. Если асцит выявлен на ранних стадиях развития, когда функции жизненно-важных органов не нарушены (или нарушены незначительно), устранение основного заболевания может привести к полному излечению пациента. В то же время, при длительно прогрессирующем асците может произойти поражение многих органов и систем (дыхательной, сердечно-сосудистой, выделительной), что приведет к смерти пациента.
- Выраженностью асцита. Транзиторный (слабовыраженный) асцит не представляет непосредственной угрозы для жизни пациента, в то время как напряженный асцит, сопровождающийся скапливанием в брюшной полости десятков литров жидкости, может привести к развитию острой сердечной или дыхательной недостаточности и смерти пациента в течение часов или дней.
- Основным заболеванием. Это, пожалуй, основной фактор, определяющий выживаемость пациентов с асцитом. Дело в том, что даже при проведении самого современного лечения благоприятный исход маловероятен, если у пациента имеется недостаточность сразу нескольких органов. Так, например, при декомпенсированном циррозе печени (когда функция органа практически полностью нарушена) шансы пациента на выживание в течение 5 лет после установки диагноза составляют менее 20%, а при декомпенсированной сердечной недостаточности – менее 10%. Более благоприятен прогноз при хронической почечной недостаточности, так как пациенты, находящиеся на гемодиализе и соблюдающие все предписания врача, могут прожить десятки лет и более.
Наличие асцита существенно утяжеляет течение основного заболевания и ухудшает его прогноз. Осложнениями самого асцита могут стать спонтанный бактериальный перитонит, печеночная энцефалопатия, гепаторенальный синдром, кровотечения.
Характеристика цирроза
Патологическое состояние печени, образовавшееся в результате серьезных сбоев в кровообращении органа, и для которого характерно стойкое поражение тканей, называется цирроз. Он угрожает не только качеству жизни пациента, но и часто становится причиной смерти, поэтому лечить его в дома народными средствами невозможно. От больного требуется соблюдение предписаний врача, прохождение регулярных обследований, корректировка поведения. А в некоторых случаях нельзя обойтись и без операции по пересадке органа.
Спровоцировать появление цирроза может гепатит. Он в свою очередь становится причиной развития ряда тяжелых патологий, таких как печеночная недостаточность, асцит, портальная гипертензия. Негативные осложнения являются чаще всего результатом запущенного состояния болезни и говорят о неблагоприятном прогнозе.