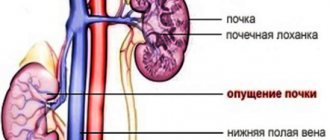
Когда возникает болезнь
Почки формируются, как и все внутренние органы ребенка, внутри утробы матери, до полугода они заметно отличаются от взрослого органа, и только к первому году жизни ребенка почки полностью приходят в норму.
Поэтому выявляются проблемы иногда в детском возрасте, а иногда – только в подростковом, когда нагрузка на них значительно увеличивается.
Предшествуют заболеваниям врожденные либо приобретенные факторы. К врожденным причинам относятся пороки, появившиеся во внутриутробном периоде:
- инфекционные, вирусные заболевания матери в период беременности;
- наследственные заболевания;
- нездоровый образ жизни беременной – курение, употребление алкогольных напитков.
Приобретенные факторы, которые способны вызвать заболевание почек у детей:
- вирусные, бактериальные инфекции;
- сахарный диабет;
- неправильное питание, недостаток воды;
- слабый иммунитет.
Частые простуды, ангины, тонзиллиты могут спровоцировать нарушения в работе почек, неправильная гигиена половых органов вызывает воспаления в мочеполовой системе, не забывая захватить и почки. Чаще этому подвергаются девочки, чем мальчики. При переохлаждении снижается кровоток во всех внутренних органах, в том числе в почках, что вызывает воспаление.
НАСЛЕДСТВЕННЫЕ НЕФРИТОПОДОБНЫЕ СИНДРОМЫ
Они выявляются чаще всего в первые два года жизни ребенка на основании почечной симптоматики или в связи с аномалиями других органов. Клинически они проявляются различными симптомами и в большей части случаев неспецифическими Латентный период после перенесения острой инфекции не удается установить При некоторых синдромах выявляют только гематурию или протеинурию, при других — картину нефротического синдрома, а в далеко зашедших случаях — недостаточность почек Такой атипизм затрудняет разграничение наследственных нефропатий от приобретенных. Такое разграничение имеет существенное значение для определения лечения и прогноза этих заболеваний. В каждом отдельном случае диагноз строится не только на основании клинических признаков, но и на подробном изучении семейного анамнеза Генеалогический анализ является одним из самых значительных методов исследования, позволяющим обнаружить наследственный характер болезни.
Диагностическое значение имеет также и наличие аминоацидурии. Допускают, что нарушение канальцевого транспорта труднорастворимых аминокислот способствует развитию наследственных нефропатий. При многих из них нарушается межуточный обмен аминокислот не только в почках, но и в других органах
Виды врожденных заболеваний
Причины врожденных заболеваний указаны выше, некоторые признаки заболевания почек могут проявляться уже у новорожденных:
- увеличенный животик;
- у мальчиков слабая струя мочи;
- изменение цвета мочи.
Возможны пожелтение кожи у новорожденных, рвота, понос. Если в почках присутствует воспалительный процесс, повышается температура тела малыша. Поэтому, если в первые дни жизни у крохи замечены отсутствие мочеиспускания либо беспокойное состояние во время этого процесса, и тем более – судороги, нужно немедленно обращаться к педиатру.
Аномалии строения почек
Неправильное развитие органов во внутриутробном периоде может вызвать проблемы с функционированием почек с рождения.
К таким аномалиям относятся:
- удвоение почек;
- удвоение мочеточника;
- подковообразная форма органа.
Таких болезни почек у детей лечатся преимущественно хирургическим вмешательством до 1 года.
Возникновение поликистоза
Это генетическое заболевание, при котором в тканях почек формируются и разрастаются кисты, заполненные жидкостью. Симптомы болезни:
- нарушение стула;
- кровь в урине;
- слабость организма, утомляемость, плохой аппетит;
- светлый цвет мочи, обильное мочеиспускание;
- кожный зуд;
- ноющие, тянущие боли в пояснице.
Функция почек не нарушена, патология может не мешать человеку вести обычный образ жизни либо перейти в хроническую форму, тогда рекомендуется прочищение почек путем диализа. Если ребенок будет вести здоровый образ жизни, заболевание не чревато серьезными последствиями.
Как проявляется мультикистоз
Генетическая либо врожденная патология, при которой изменяется почечная ткань, и частично изменяются функции почек – требуется наблюдение врачей: если киста не растет, не давит на орган, то хирургического вмешательства может и не потребоваться. При росте кисты предстоит удаление органа.
Симптоматика мегауретера
Проявления патологии заключаются в том, что урина из мочевого пузыря забрасывается обратно в мочевыводящую систему.
Причинами являются:
- слабое развитие мочеиспускательного канала;
- незрелость нервной системы новорожденного крохи.
Устраняется обычно хирургическим путем.
Что представляет собой врожденный гидронефроз
При этом заболевании из-за суженного либо недоразвитого просвета нижней части мочеточника в почках происходит застой мочи. Обычно патологию выявляют до рождения малыша во время проведения УЗИ беременной женщины, тогда в первые месяцы жизни патологию устраняют оперативным путем.
Врожденные аномалии мочеполовой системы (ВАМПС) составляют 20–30% всех врожденных аномалий, выявляемых при пренатальном ультразвуковом исследовании. В мире около 40-50% случаев почечной недостаточности у детей связано с врожденными аномалиями мочевой системы [1]. Врожденные аномалии мочеполовой системы включают в себя широкий спектр структурных и функциональных заболеваний почек и мочевыводящих путей. К ним относятся следующие заболевания: гипоплазия/дисплазия почек, агенезия почек, кистозные заболевания почек, удвоение, обструкция на уровне лоханочномочеточникового и пузырно-мочеточникового сегментов, пузырно-мочеточниковый рефлюкс, мегауретер, гидронефроз и клапаны задней уретры. Они могут быть изолированными или же частью мультиорганного синдрома [2, 3]. ВАМПС могут быть следствием хромосомных болезней, вызванных геномными или структурными нарушениями, они не являются наследственными заболеваниями, хотя и относятся к генетически обусловленной патологии. Хромосомные болезни характеризуются, как правило, множественными пороками развития различных органов.
Частота поражений почек и органов мочевыделения при ряде хромосомных болезней может быть довольно высокой. При трисомии хромосомы 21, утрате части длинного плеча 18 хромосомы, частота пороков развития органов мочевой системы превышает частоту аналогичных аномалий органов мочевой системы в популяции. При синдроме трисомии хромосомы 9 у мальчиков отмечается крипторхизм и микропенис, при синдроме Паттау часто встречается поликистоз почек, при синдроме Шерешевского-Тернера также часто встречаются врожденные пороки почек, при синдроме Синдром Миллера-Диккера описаны случаи аганезии почек.
Существуют данные о том, что врожденные заболевания почек могут быть следствием мутации в одном гене (моногенные ВАМПС). Этот фактор подтверждается следующими положениями:
- ВАМПС могут иметь семейный характер [4];
- в моногенных моделях на мышах были получены фенотипы ВАМПС;
- мультиорганные моногенные синдромы человека могут включать в себя фенотипы ВАМПС.
Недавно гипотеза о моногенной природе ВАМПС подтвердилась обнаружением более 20 генов, ответственных за развитие ВАМПС у людей [5–9]. До этого было известно лишь несколько генов, мутации в которых, являются причиной ВАМПС. Большая часть их обнаружена у людей с семейными синдромами, в том числе HNF1B (синдром кист почек и диабета – Renal Cysts and Diabetes Syndrome) [10], PAX2 (почечный синдром Coloboma – Renal Coloboma Syndrome) [11] и EYA1 (брахио-ото-ренальный синдром – branchio-oto-renal syndrome) [12].
Одной из первых ВАМПС, генетическая основа которого оказалась изучена, стал поликистоз почек. Причиной этого заболевания являются мутации в генах PKD1 и PKD2, которые кодируют белки полицистин 1 и полицистин 2, соответственно. До недавнего времени молекулярно-генетическая диагностика этого заболевания была сложна, однако сейчас можно диагностировать 90% случаев наследственного поликистоза почек, что очень важно для прогнозирования течения заболевания и, особенно, в отношении донорской трансплантации почки. Аутосомнорецессивный поликистоз почек характеризуется появлением двусторонних кист почек, он может начаться уже in utero. Это заболевание развивается сразу после рождения или в подростковом возрасте, в зависимости от пенетрантности компаунд-гетерозигот по рецессивным мутациям в гене PKHD1.
Последние исследования показали, что ВАМПС могут вызваться мутациями в нескольких генах (табл. 1) с аутосомно-доминантным или рецессивным типом наследования [10-12, 13-41].
Таблица 1. Гены – причины изолированных ВАМПС и синдромов с преобладанием фенотипа ВАМПС у человека
| Символ гена | Почечный фенотип | Экстраренальный фенотип | Модель на мышах Het/ Homd | Литературный источник | |
| А. Доминантные ВАМПС | |||||
| BMP4 | Почечная гипоплазия | Микроофтальмия | ВАМПС | [13] | |
| EYA1 | Мультикстоз почки, почечная аплазия | Глухота, аномалии уха, бронхиальные кисты | ВАМПС | ВАМПС | [12] |
| GATA3 | Почечная дисплазия | Гипопаратероидизм, аномалии сердца, иммунодефицит, глухота | нет | [14, 15] | |
| HNF1B | Гипоплазия почек, единственная почка, подковообразная почка | Сахарный диабет, гиперурикемия, гипомагнезиемия | нет | [10] | |
| KAL1 | Агенезия почки | Микропенис, двусторонний крипторхизм, аносмия | [17] | ||
| PAX2 | ПМР, гипоплазия почек | Снижение слуха | ВАМПС | ВАМПС | [11,18] |
| RET | Агенезия почки | нет | ВАМПС | [19, 20] | |
| ROBO2 | ПМР, дефекты пузырномоче точникового соединения | None | нет | ВАМПС | [21] |
| SALL1 | Гиподисплазия почек, агенезия почек | Аномалии конечностей, глаз, анального канала | ВАМПС | ВАМПС | [22] |
| SIX1 | Гиподисплазия почек, ПМР | Глухота, дефекты уха, бронхиальные кисты | нет | ВАМПС | [38] |
| SIX2 | Гиподисплазия почек | None | нет | ВАМПС | [13, 28] |
| SIX5 | Гиподисплазия почек, ПМР | Глухота, дефекты уха, бронхиальные кисты | нет | нет | [24] |
| SOX17 | ПМР, обструкция на уровне пузырно-мочеточникового сегмента | нет | нет | [25] | |
| TNXB | ПМР | Гипермобильность суставов | нет | нет | [26] |
| UPK3A | Гиподисплазия почек | Дефекты лица и конечностей | нет | ВАМПС | [27] |
| WNT4 | Гиподисплазия почек | Нарушение формирования пола, дисплазия надпочечников и легких (SERKAL) | нет | ВАМПС | [29-31] |
| CHD1L | Гиподисплазия почек, ПМР, обструкция на уровне пузырномочеточникового сегмента | Нет | [32] | ||
| DSTYK | Гиподисплазия почек, обструкция на уровне пузырномочеточникового сегмента | Эпилепсия | [33] | ||
| MUC1 | Медуллярная кистозная болезнь почек тип 1 | – | ? | [42] | |
| UMOD | Медуллярная кистозная болезнь почек тип 2 | Гиперурикемия | ВАМПС | [34] | |
| В. Рецессивные ВАМПС | |||||
| ACE | Отсутствие или неполная дифференцировка проксимальных канальцев | Легочная гипоплазия (Potter sequence), аномалии черепа | нет | ВАМПС | [35, 36,39] |
| AGT | Схоже с ACE | Схоже с ACE | нет | ВАМПС | [35, 36] |
| AGTR1 | Схоже с ACE | Схоже с ACE | нет | ВАМПС? | [35, 36] |
| REN | Схоже с ACE | Схоже с ACE | нет | ВАМПС | [35, 36] |
| FGF20 | Двусторонняя агенезия почек | Нет | нет | ВАМПС | [37] |
| TRAP1 | ПМР, агенезия почек | VACTERL синдром | [40] | ||
| FRAS1 | Агензия почек | Криптофтальм, аномалии носа и глотки, задержка психического развития и синдактилия | нет | ВАМПС | [41] |
| FREM2 | Агензия почек | Криптофтальм, аномалии носа и глотки, задержка психического развития и синдактилия | нет | ВАМПС | [41] |
Возникновение ВАМПС связано с нарушением нормального нефрогенеза и может вызываться мутациями в генах, ответственных за этот процесс.
Для того чтобы понять и выявить причины ВАМПС, необходимо детально проанализировать процесс развития мочеполовой системы. Развитие почки можно разделить на следующие этапы: возникновение зачатка мочеточника, переход мезенхима – эпителий (MET), морфогенез сети почки и развитие нефрона (включает в себя морфогенез проксимальных и дистальных канальцев и гломерулогенез) [4, 16, 43-46] (табл. 2). Молекулярный контроль этих процессов развития регулируется большим количеством генов и сигнальных путей.
Таблица 2. Гены, регулирующие развитие почек и верхних мочевыводящих путей
| Этапы развития почки | Гены у человека | Гены у мышей | ||||||
| Формирование зачатка мочеточника | BMP4, EMX2 EYA1 FOXC1 FOXC2 | GDNF GFRA1 GREM1 HOXA 11 ISL1 | ITGA8 LHX1 LIM1 OSR1 PAX2 | RET ROBO2 HS2ST SALL SIX | SIX2 SLIT2 SPRY1 WT1 HOXC 11 | HOXD11 | Bmp4 Eya1 Gаta3 | Pax2 Ret Robo2 |
| Проникновение в мезенхиму | BMP4 BMP7 EYA1 | FGF20 LIM 1 TGFB2 | WNT4 WNT9B FGF8 | FGF9 OSR1 SIX2 | SMAD4 TCF 21 | Fgf20 Wnt4 | ||
| Морфогенез собирательной системы | BMP4 BMP7 GPC 3 GREM1 POD1 PTEN PAX2 | FFGR1 FFGR2 HOXA11 HOXC11 RARA SPRY1 | AGT (ангиотензин) AGTR (рецептор ангиотензина 1 и 2) HOXD 11 MET WNT11 | Agt Agtr | ||||
| Формирование и созревание нефрона | PAX2 UMOD WTQ | AGT JAG1 Agt-рецептор | NOTCH2 | Umod | ||||
Нарушение на любом из этапов развития, как показано в моделях на мышах, может привести к появлению клинического фенотипа ВАМПС. Понимание молекулярных механизмов контроля формирования мочеполовой системы переключило внимание в изучении этих процессов с классических анатомических теорий на современный клеточный и генетический принцип понимания этиологии ВАМПС [47]. Развитие почки начинается с формирования двустороннего пронефроса (NDs), который перемещается латерально в теле эмбриона. Около нижних конечностей из нефротической закладки образуется вырост, носящий название зачаток мочеточника (UB). Он проникает в близлежащую метанефротическую мезенхиму (ММ), удлиняется и разветвляется в будущую собирательную систему почки. Область зачатка мочеточника (UB), не прорастающая в ММ, дает начало мочеточнику, соединяющего почку с мочевым пузырем. Аномалии зачатка мочеточника, созревания и дифференцировки всех слоев дистального отдела мочеточника связаны с развитием ВАМПС.
Генетические исследования на мышах позволили идентифицировать ключевые гены и механизмы регуляции, которые могут являться причинами ВАМПС [4].
ГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ВОЗНИКНОВЕНИЯ ВАМПС НА ЭТАПЕ ФОРМИРОВАНИЯ ЗАЧАТКА МОЧЕТОЧНИКА
I. Ichikawa и соавт. предложили теорию «зачатка» – зачаток мочеточника должен выходить в определенном месте из пронефроса и войти в центр ММ для нормального развития почки [47]. Если зачаток возникает ростральнее или каудальнее, происходит его неправильная пенетрация в ММ, что ведет к гипоплазии или дисплазии почки из-за нарушения морфои нефрогенеза. Отсутствие или несколько зачатков мочеточника соответственно могут привести к агенезии (одноили двусторонней) или удвоению почки. Ростральное или каудальное смещение зачатка мочеточника также может привести к эктопии его впадения в мочевой пузырь и стать причиной обструкции на уровне пузырно-мочеточникового сегмента или причиной ПМР. «Теория о зачатке мочеточника» подтвердилась в исследованиях на мышах с нарушениями в генах Bmp4, Grem1, Gdnf, Ret, Foxc1/c2, Robo2, Slit2, Spry1 и Itga8, участвующих в определении места возникновения зачатка мочеточника и его развитии, приводящих к возникновению ВАМПС [6]. Исходно обнаружено, что у человека мутации в гене RET вызывают множественную эндокринную неоплазию [48] и болезнь Гиршпрунга [49]. Мутации в этом гене приводят также к формированию ВАМПС у плодов в виде двустороней гипоплазии/агенезии почки [50]. Кроме того, роль гена RET как причины ВАМПС подтверждает и тот факт, что у многих пациентов с болезнью Гирш-прунга имеются сочетанные не диагностированные ВАМПС [51]. Регуляторный механизм сигнального пути GDNF-RET играет центральную роль в формировании зачатка мочеточника, поэтому мутации в генах этого сигнального пути могут приводить к развитию ВАМПС. Оказалось, что мутации в генах факторов транскрипции, таких как PAX2, EYA1 и SALL1, приводят к возникновению ВАМПС с синдромспецифическими экстракраниальными проявлениями. Мутации PAX2 впервые описаны у пациентов с синдромом Renal Coloboma, включающие в себя гипоплазию почки, аномалии глазного нерва и глухоту [10]. К настоящему моменту в мире описано 55 заболеваний, вызванных мутациями гена PAX2 [18]. Мутации гена EYA1 приводят к возникновению БОР-синдрома (бранхио-оторенальный синдром), характеризующегося аномалиями развития наружного уха, кисты шеи, нарушением слуха, аномалиями развития почек (от гипоплазии до агенезии) [12]. Интересно, что мутации в генах SIX1 и SIX5 впервые обнаружены у пациентов с EYA1-отрицательным БОР-синдромом, вероятно они представляют собой более редкую причину заболевания [23, 24]. Мутации SALL1 ведут к возникновению Townes-Brocks синдрома, характеризующегося аномалиями почек, анального канала, уха и конечностей [22]. BMP4 экспрессируется в клетках мезенхимы, окружающих Вольфов проток, и ингибирует GDNF-RETрегуляторный механизм [39].
ГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ВОЗНИКНОВЕНИЯ ВАМПС НА ЭТАПЕ МЕЗЕНХИМАЛЬНОЭПИТЕЛИАЛЬНОГО ПЕРЕХОДА
После того как зачаток мочеточника проникает в ММ индуцируется активация метанефрогенных мезенхимальных клеток. Этот этап начинается с поляризации мезенхимы для возникновения эпителиальных клеток нефрона, а процесс носит название мезенхимно-эпителиальный переход (MET) [43, 44]. Ключевую роль в этом процессе играют белки WNT, в частности белки WNT9b и WNT4 [43, 44]. Кроме того, в последних исследованиях на мышах показано, что сигнальный механизм с участием белков WNT частично регулируется [52]. Мутации генов WNT4 или SIX2 выявлены у детей с ВАМПС [13, 31]. Другую важную роль в процессе MET играет фактор роста фибробластов [43, 44]. Кроме того, недавно представлены данные о мутации в гене FGF20, что привело к двусторонней агенезии почек у трех плодов в родственных семьях [37].
ГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ВОЗНИКНОВЕНИЯ ВАМПС НА ЭТАПЕ ФОРМИРОВАНИЯ СОБИРАТЕЛЬНОЙ СИСТЕМЫ ПОЧКИ
Следующим этапом развития почки является морфогенез собирательной системы. Во время этого периода на окончании зачатков собирательной системы формируются нефроны. Одним из факторов, регулирующим этот процесс, является ангиотензин 2, активирующий рецепторы ангиотензина 1 и 2 типа, что стимулирует морфогенез [53]. Соответственно мутации в компонентах ренин-ангиотензиновой системы, таких как: AGT (ангиотен-зиноген), REN (ренин), ACE (ангиотензин-превращающий фермент) и AGTR1 (рецептор ангиотензина II 1 типа), связаны с тяжелыми фенотипическими проявлениями ВАМПС в виде почечной тубулярной дисгенезии [35]. Эти редкие аутосомно-рецессивные заболевания характеризуются ранней анурией плода, приводящей к олигогидрамниону. В экспериментах на мышах проводилась инактивация различных компонентов ренин-ангиотензиновой системы. Установлено, что у мышей с генотипом NULL по генам AGTR2 и AGT [54] имеются ВАМПС, этот фенотип не развивается у мышей с генотипом NULL по генам ACE и REN. Эти факты показывают возможные различия между экспериментальными моделями на мышах и человеческими заболеваниями.
ГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ВОЗНИКНОВЕНИЯ ВАМПС НА ЭТАПЕ ФОРМИРОВАНИЯ НЕФРОНА
В то время как большое внимание уделяется ранним этапам формирования почки, гораздо меньше известно о генетическом регулировании процесса формирования нефрона [46]. Единственным установленным у человека геном, регулирующим этот процесс, является ген UMOD. Ген уромодулина – Uromodulin (UMOD), кодирует белок Tamm-Horsfall, один из самых многочисленных белков в организме человека [55]. Мутации UMOD являются причиной различных почечных заболеваний: поликистоз почек 2 типа (MCKD2), семейная ювенильная гиперурикемическая нефропатия (FJHN) и гломерулокистозная болезнь почек (GCKD) [34]. Все эти заболевания имеют аутосомно-доминантный тип наследования.
ГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ВОЗНИКНОВЕНИЯ ВАМПС НА ЭТАПЕ ФОРМИРОВАНИЯ СОЕДИНЕНИЯ МОЧЕТОЧНИКА И МОЧЕВОГО ПУЗЫРЯ
После проникновения пронефроса в клоаку, появляется и проникает в ММ зачаток мочеточника, далее мочеточник отделяется от общего протока пронефроса (CND, самый дистальный сегмент протока пронефроса) и проникает в мочевой пузырь. Этот процесс носит название «созревание дистального отдела мочеточника» и зависит от апоптоза CND, регулируется сигнальным путем с участием ретиноидной кислоты, рецепторов LAR-семейства белков тирозин-фосфаты, Ret и Dlg1 [56–58]. Мочеточник состоит из нескольких клеточных слоев: уротелий, субэпителиальная мезенхима мочеточника (или стромальный слой), гладкомышечный слой и адвентиция. В гладкомышечном слое на уровне лоханки находятся клетки пейсмейкеры, вызывающие однонаправленную перистальтику мочеточника. Нарушения в генах SHH, GLI3, TSHZ3, BMP4, UPK2, UPK3, BRG1, TBX18, генах семейства ренинангиотензиновой системы, DLG1, KIT и HCN3, экспрессируемых в этих клетках, приводят к развитию мегауретера, гидронефроза, ПМР и/или обструкции [59, 60].
Существует мнение о том, что мутации в генах, вызывающие ВАМПС, согласно исследованиям, проведенным на мышах, можно использовать для генетического тестирования у человека. Однако, скрининг пациентов по индивидуальным генам, вызывающим ВАМП, показал, что за исключением генов HNF1B и PAX2, мутации в большинстве тестируемых генов встречают в небольшом количестве случаев [61]. Гено-фенотипические корреляции у разных носителей мутаций в одной и той же семье могут быть очень сложными, мутация в одном гене может быть причиной различным аномалий. К этому еще нужно добавит тот факт, что многие ВАМПС остаются не диагностированными [62].
В настоящее время уже существуют готовые панели, предназначенные для тестирования групп генов с помощью высокопроизводительного секвенирования нового поколения для диагностики заболеваний почек и мочевыводящих путей. К ним относятся, например:
- KidneySeq™: A Comprehensive Genetic Kidney Disease Panel, исследуются 170 различных генов, ответственных за 75 заболеваний мочеполовой системы;
- Ion AmpliSeq™Inherited Disease Panel target gene list, оцениваются такие заболевания как поликистоз почек, брахиоторенальный синдром, опухоль Вильмса;
- Autosomal Dominant and Recessive Polycystic Kidney Disease NextGen Sequencing (NGS) Panel, Autosomal Dominant Polycystic Kidney Disease Sequencing Panel, Ashkenazi Jewish Carrier Multi-Gene Expanded Panel включают в себя диагностику поликистоза почек;
- Branchiootorenal Syndrome Panel, OtoSeq Hearing Loss Deletion/Duplication Panel, OtoSeq Hearing Loss Panel включают себя диагностику брахиоторенального синдрома;
- Congenital Central Hypoventilation NGS Panel включает в себя диагностику агенезии почек.
ПЕРСПЕКТИВЫ ИЗУЧЕНИЯ ГЕНОВ – ПРИЧИН ВАМПС
В настоящее время большая часть исследований направлена на выявление новых генов, мутации в которых могут быть причиной ВАМПС, для улучшения генетического тестирования и расширения понимания этиологии широкого спектра фенотипов ВАМПС.
Секвенирование нового поколения (Next-generation sequencing (NGS)) сделало возможным проводить скрининг пациентов с ВАМПС для поиска мутаций в нескольких генах [63]. Этот анализ, в комбинации с секвенированием всего экзома, позволил определить новые гены, мутации в которых возможно являются причиной ВАМСП (DSTYK, TRAP1, TNXB) [64-66]. Двойная серин/треонин и тирозин киназа (DSTYK) – активирует фосфорилирование ERK, что при-водит к активации рецептора FGF. DSTYK находится рядом с FGF-рецепторами в зачатке мочеточника и ММ. Мутации в DSTYK могут нарушать FGF сигнальный путь и привести к возникновению ВАМПС [35]. Белок, связанный с TNF рецепторами (TRAP1) – белок теплового шока 90, связанный с митохондриальными шаперонами и, в основном, экспрессируемый в проксимальных канальцах и восходящей части петли Генле. Мутации гена TRAP1 могут быть причиной апоптоза, вызванного активными формами кислорода, и стимулировать активацию стрессовых генов и аутофагию, что соответственно отразится на развитии поч-ки [15]. Тенасцин (Тenascin XB (TNXB)) экспрессируется в уротелиальном слое пузырномочеточникового соустья. Отмечается его более активная экспрессия в базальных клетках уротелия у пациентов с ПМР по сравнению с контрольными [26]. Мутации гена TNXB могут приводить к нарушению запирательного механизма в области пузырно-мочеточникого соустья и к возникновению ПМР. Ранее считалось, что мутации в генах FRAS1, FREM2, GRIP1, FREM1) связаны с синдромом Фразера, однако в настоящее время доказано, что они могут быть и причиной изолированных аномалий мочеполовой системы [67].
ЗАКЛЮЧЕНИЕ
Несмотря на то, что в большинстве случаев не удается выявить гены-причины ВАМПС, аберрации в определенных областях генома позволяют картировать новые гены, мутации в которых могут являться причиной ВАМПС. Нет сомнений в том, что в ближайшие годы секвенирование нового поколения позволит выявить новые мутации и гены, вовлеченные в развитие ВАМПС у человека. Комбинирование данных об этих новых генах с мутационными исследованиями на мышах позволят определить точные механизмы и прольют свет на этиологию всего спектра структурных аномалий мочеполовой системы.
Работа выполнена в рамках Госзадания.
ЛИТЕРАТУРА
1. Woolf AS, Price KL, Scambler PJ, Winyard PJ. Evolving concepts in human renal dysplasia. J Am Soc Nephrol 2004; 15 (4): 998–1007.
2. Australian and New Zealand Dialysis and Transplant Registry. Annual Paediatric Report. 2012. 3. North American Paediatric Renal Transplant Cooperative Study. Annual Report. Rockville. MD: The EMMES Corporation. 2008.
4. Bulum B, Ozcakar ZB, Ustuner E, Dusunceli E, Kavaz A, Duman D, et al.High frequency of kidney and urinary tract anomalies in asymptomatic first-degree relatives of patients with CAKUT. Pediatr Nephrol 2013; 28 (11): 2143–2147.
5. Yosypiv IV. Congenital anomalies of the kidney and urinary tract: a genetic disorder? Int J Nephrol 2012; Article ID 909083, 10 pages. (URL: http:/ /dx.doi.org/10.1155/2012/909083)/
6. Chen F. Genetic and developmental basis for urinary tract obstruction. Pediatr Nephrol 2009; 24 (9): 1621–1632.
7. Renkema KY, Winyard PJ, Skovorodkin IN, Levtchenko E, Hindryckx A, Jeanpierre C, et al, Novel perspectives for investigating congenital anomalies of the kidney an urinary tract (CAKUT) Nephrology, dialysis, transplantation : official publication of the European Dialysis and Transplant Association. Eur Renal Ass 2011; 26: 3843–3851.
8. Sanna-Cherchi S, Caridi G, Weng PL, Scolari F, Perfumo F, Gharavi AG, et al. Genetic approaches to human renal agenesis/hypoplasia and dysplasia. 22. Kohlhase J, Wischermann A, Reichenbach H, Froster U, Engel W. Mutations Pediatr Nephrol 2007; 22 (10): 1675–1684.
9. Weber S. Novel genetic aspects of congenital anomalies of kidney and urinary tract. Curr Opin Pediatr 2012; 24 (2); 212–218.
10. Lindner TH, Njolstad PR, Horikawa Y, Bostad L, Bell GI, Sovik O. A novel syndrome of diabetes mellitus, renal dysfunction and genital malformation associated with a partial deletion of he pseudo-POU domain of hepatocyte nuclear factor-1ß. Hum Mol Genet 1999; 8 (11): 2001–2008.
11. Sanyanusin P, Schimmenti LA, McNoe LA, Ward TA, Pierpont ME, Sullivan MJ, et al. Mutation of the PAX2 gene in a family with optic nerve colobomas, renal anomalies and vesicoureteral reflux. Nat Genet 1995; 9 (4): 358–364.
12. Abdelhak S, Kalatzis V, Heilig R, Compain S, Samson D, Vincent C, et al. A human homologue of the Drosophila eyes absent gene underlies branchio-oto-renal (BOR) syndrome and identifies a novel gene family. Nat Genet 1997; 15 (2): 157–164.
13. Weber S, Taylor JC, Winyard P, Baker KF, Sullivan-Brown J, Schild R, et al.. SIX2 and BMP4 mutations associate with anomalous kidney development. J Am Soc Nephrol 2008; 9 (5): 891–903.
14. Pandolfi PP, Roth ME, Karis A, Leonard MW, Dzierzak E, Grosveld FG, et al. Targeted disruption of the GATA3 gene causes severe abnormalities in the nervous system and in fetal liver haematopoiesis. Nat Genet 1995; 11 (1): 40–44.
15. Van Esch H, Groenen P, Nesbit MA, Schuffenhauer S, Lichtner P, Vanderlinden G, et al.. GATA3 haplo-insufficiency causes human HDR syndrome. // Nature 2000; 406 (6794): 419–422.
16. Horikawa Y, Iwasaki N, Hara M, Furuta H, Hinokio Y, Cockburn BN, et al.. Mutation in hepatocyte nuclear factor-1 beta gene (TCF2) associated with MODY. // Nat Genet 1997; 17 (4): 384–385.
17. Hardelin JP, Levilliers J, del Castillo I, Cohen-Salmon M, Legouis R, Blanchard S, et al. . X chromosome-linked Kallmann syndrome: stop mutations validate the candidate gene. Proc Natl Acad Sci U S A 1992; 89 (17): 8190–8194.
18. Bower M, Salomon R, Allanson J, Antignac C, Benedicenti F, Benetti E, et al. Update of PAX2 mutations in renal coloboma syndrome and establishment of a locus-specific database. Hum Mutat 2012; 33 (3): 457–466.
19. Skinner MA, Safford SD, Reeves JG, Jackson ME, Freemerman AJ. Renal aplasia in humans is associated with RET mutations. Am J Hum Genet 2008; 82 (2): 344–351.
20. Yang Y, Houle AM, Letendre J, Richter A. RET Gly691Ser mutation is associated with primary vesicoureteral reflux in the French-Canadian population from Quebec. Hum Mutat 2008; 29 (5): 695–702.
21. Lu W, van Eerde AM, Fan X, Quintero-Rivera F, Kulkarni S, Ferguson H, et al. . Disruption of ROBO2 is associated with urinary tract anomalies and confers risk of vesicoureteral reflux. Am J Hum Genet 2007; 80 (4): 616–632.
22. Kohlhase J, Wischermann A, Reichenbach H, Froster U, Engel W. Mutations in the SALL1 putative transcription factor gene cause Townes-Brocks syndrome. Nat Genet 1998; 18 (1): 81–83.
23. Ruf RG, Xu PX, Silvius D, Otto EA, Beekmann F, Muerb UT, et al. SIX1 mutations cause branchio-oto-renal syndrome by disruption of EYA1-SIX1-DNA complexes. Proc Natl Acad Sci USA 2004; 101 (21): 8090–8095.
24. Hoskins BE, Cramer CH, Silvius D, Zou D, Raymond RM, Orten DJ, et al. Transcription factor SIX5 is mutated in patients with branchio-oto-renal syndrome. Am J Hum Genet 2007; 80 (4): 800–804.
25. Gimelli S, Caridi G, Beri S, McCracken K, Bocciardi R, Zordan P, et al. Mutations in SOX17 are associated with congenital anomalies of the kidney and the urinary tract. Hum Mutat 2010; 31 (12): 1352–1359.
26. Gbadegesin RA, Brophy PD, Adeyemo A, Hall G, Gupta IR, Hains D, et al. TNXB Mutations Can Cause Vesicoureteral Reflux. J Am Soc Nephrol 2013; 24 (8): 1313-1322.
27. Jenkins D, Bitner-Glindzicz M, Malcolm S, Hu CC, Allison J, Winyard PJ, et al. De novo Uroplakin IIIa heterozygous mutations cause human renal adysplasia leading to severe kidney failure. J Am Soc Nephrol 2005; 16 (7): 2141–2149.
28. Self M, Lagutin OV, Bowling B, Hendrix J, Cai Y, Dressler GR, et al. Six2 is required for suppression of nephrogenesis and progenitor renewal in the developing kidney. Embo J 2006; 25 (21): 5214–5228.
29. Biason-Lauber A, Konrad D, Navratil F, Schoenle EJ. A WNT4 mutation associated with Mullerian-duct regression and virilization in a 46,XX woman. N Engl J Med 2004; 351 (8): 792–798.
30. Mandel H, Shemer R, Borochowitz ZU, Okopnik M, Knopf C, Indelman M, et al. SERKAL syndrome: an autosomal-recessive disorder caused by a loss-offunction mutation in WNT4. Am J Hum Genet 2008; 82 (1): 39–47.
31. Vivante A, Mark-Danieli M, Davidovits M, Harari-Steinberg O, Omer D, Gnatek Y, et al. Renal hypodysplasia associates with a WNT4 variant that causes aberrant canonical WNT signaling. J Am Soc Nephrol 2013; 24 (4): 550–558.
32. Brockschmidt A, Chung B, Weber S, Fischer DC, Kolatsi-Joannou M, Christ L, et al. CHD1L: a new candidate gene for congenital anomalies of the kidneys and urinary tract (CAKUT). Nephrol Dial Transplant 2012; 27 (6): 2355–2364.
33. Sanna-Cherchi S, Sampogna RV, Papeta N, Burgess KE, Nees SN, Perry BJ, et al. Mutations in DSTYK and Dominant Urinary Tract Malformations. Semin Nephrol. 2009; 29 (4): 321–337. N Engl J Med 2013; 369 (7): 621-629.
34. Hart TC, Gorry MC, Hart PS, Woodard AS, Shihabi Z, Sandhu J, et al. Mutations of the UMOD gene are responsible for medullary cystic kidney disease 2 and familial juvenile hyperuricaemic nephropathy. J Med Genet 2002; 39 (12): 882–892.
35. Gribouval O, Gonzales M, Neuhaus T, Aziza J, Bieth E, Laurent N, et al. Mutations in genes in the renin-angiotensin system are associated with autosomal recessive renal tubular dysgenesis. Nat Genet 2005; 37 (9): 964–968.
36. Gribouval O, Moriniere V, Pawtowski A, Arrondel C, Sallinen SL, Saloranta C, et al. Spectrum of mutations in the renin-angiotensin system genes in autosomal recessive renal tubular dysgenesis. Hum Mutat 2012; 33 (2): 316–326.
37. Barak H, Huh SH, Chen S, Jeanpierre C, Martinovic J, Parisot M, et al. FGF9 and FGF20 maintain the stemness of nephron progenitors in mice and man. Dev Cell 2012; 22 (6): 1191–1207.
38. Ruf RG, Berkman J, Wolf MT, Nurnberg P, Gattas M, Ruf EM, et al. A gene locus for branchio-otic syndrome maps to chromosome 14q21.3-q24.3. J Med Genet 2003; 40 (7): 515–519.
39. Esther CR, Marino EM, Howard TE, Machaud A, Corvol P, Capecchi MR, et al. The critical role of tissue angiotensin-converting enzyme as revealed by gene targeting in mice. J Clin Invest 1997; 99 (10): 2375–2385.
40. McGregor L, Makela V, Darling SM, Vrontou S, Chalepakis G, Roberts C, et al. . Fraser syndrome and mouse blebbed phenotype caused by mutations in FRAS1/Fras1 encoding a putative extracellular matrix protein. Nat Genet 2003; 34 ( 2): 203–208.
41. Jadeja S, Smyth I, Pitera JE, Taylor MS, van Haelst M, Bentley E, et al.. Identification of a new gene mutated in Fraser syndrome and mouse myelencephalic blebs. Nat Genet 2005; 37 (5): 520–525.
42. Kirby A, Gnirke A, Jaffe DB, Barešová V, Pochet N, Blumenstiel B, et al. Mutations causing medullary cystic kidney disease type 1 lie in a large VNTR in MUC1 missed by massively parallel sequencing. Nat Genet 2013; 45 (3): 299–303.
43. Dressler GR. Advances in early kidney specification, development and patterning. Development 2009; 136 (23): 3863–3874.
44. Reidy KJ, Rosenblum ND. Cell and molecular biology of kidney development. Semin Nephrol 2009; 29 (4): 321–337.
45. Faa G, Gerosa C, Fanni D, Monga G, Zaffanello M, Van Eyken P, et al. Morphogenesis and molecular mechanisms involved in human kidney development. J Cell Physiol 2012; 227 (3): 1257–1268.
46. Vainio S, Lin Y. Coordinating early kidney development: lessons from gene targeting. Nat Rev Genet 2002; 3 (7): 533–543.
47. Ichikawa I, Kuwayama F, Pope JC, Stephens FD, Miyazaki Y. Paradigm shift from classic anatomic theories to contemporary cell biological views of CAKUT. Kidney Int 2002; 61 (3): 889–898.
48. Santoro M, Carlomagno F, Romano A, Bottaro DP, Dathan NA, Grieco M, et al. Activation of RET as a dominant transforming gene by germline mutations of MEN2A and MEN2B. Science 1995; 267 ( 5196):381–383.
49. Romeo G, Ronchetto P, Luo Y, Barone V, Seri M, Ceccherini I, et al. Point mutations affecting the tyrosine kinase domain of the RET proto-oncogene in Hirschsprung’s disease. Nature 1994; 367 ( 6461): 377–378.
50. Jeanpierre C, Mace G, Parisot M, Moriniere V, Pawtowsky A, Benabou M, et al. RET and GDNF mutations are rare in fetuses with renal agenesis or other severe kidney development defects. J Med Genet 2011; 48 (7): 497–504.
51. Pini Prato A, Musso M, Ceccherini I, Mattioli G, Giunta C, Ghiggeri GM, et al. Hirschsprung disease and congenital anomalies of the kidney and urinary tract (CAKUT): a novel syndromic association. Medicine 2009; 88 (2): 83–90.
52. Park JS, Ma W, O’Brien LL, Chung E, Guo JJ, Cheng JG, et al. Six2 and Wnt regulate self-renewal and commitment of nephron progenitors through shared gene regulatory networks. Dev Cell 2012; 23 (3): P. 637–651.
53. Reidy KJ, Rosenblum ND. Cell and molecular biology of kidney development. Semin Nephrol. 2009; 29 (4): 321–337.
54. Nishimura H, Yerkes E, Hohenfellner K, Miyazaki Y, Ma J, Hunley TE, Yoshida H, et al. Role of the angiotensin type 2 receptor gene in congenital anomalies of the kidney and urinary tract, CAKUT, of mice and men. Mol Cell 1999; 3 (1):1–10.
55. Tamm I, Horsfall FLJr. Characterization and separation of an inhibitor of viral hemagglutination present in urine. Proc Soc Exp Biol Med 1950; 74 (1): 106–108.
56. Chia I, Grote D, Marcotte M, Batourina E, Mendelsohn C, Bouchard M. Nephric duct insertion is a crucial step in urinary tract maturation that is regulated by a Gata3-Raldh2-Ret molecular network in mice. Development 2011; 138 (10): 2089–2097.
57. Mackie GG, Stephens FD. Duplex kidneys: A correlation of renal dysplasia with position of the ureteral orifice. J Urol 1975; 114 (2): 274–280.
58. Costantini F. Genetic controls and cellular behaviors in branching morphogenesis of the renal collecting system. Wiley Interdiscip Rev Dev Biol 2012; 1 (5): 693–713.
59. Batourina E, Tsai S, Lambert S, Sprenkle P, Viana R, Dutta S, et al. Apoptosis induced by vitamin A signaling is crucial for connecting the ureters to the bladder. Nat Genet 2005; 37 (10): 1082–1089.
60. Uetani N, Bertozzi K, Chagnon MJ, Hendriks W, Tremblay ML, Bouchard M. Maturation of ureter-bladder connection in mice is controlled by LAR family receptor protein tyrosine phosphatases. J Clin Invest 2009; 119 ( 4): 924–935.
61. Kim ST, Ahn SY, Swat W, Miner JH. DLG1 influences distal ureter maturation via a non-epithelial cell autonomous mechanism involving reduced retinoic acid signaling, Ret expression, and apoptosis. Dev Biol. 2014; 390 (2): 160–169.
62. Bohnenpoll T, Kispert A. Ureter growth and differentiation. Semin Cell Dev Biol 2014; 36: 21–30.
63. Rasouly HM, Lu W. Lower urinary tract development and disease. Wiley Interdiscip Rev Syst Biol Med 2013; 5 (3): 307–342.
64. Renkema KY, Winyard PJ, Skovorodkin IN, Levtchenko E, Hindryckx A, Jeanpierre C, et al. Novel perspectives for investigating congenital anomalies of the kidney and urinary tract (CAKUT). Nephrol Dial Transplant 2011; 26 (12): 3843–3851.
65. Saisawat P, Tasic V, Vega-Warner V, Kehinde EO, Günther B, Airik R, et al. Identification of two novel CAKUT-causing genes by massively parallel exon resequencing of candidate genes in patients with unilateral renal agenesis. Kidney Int 2012; 81 (2): 196–200.
66. Saisawat P, Kohl S, Hilger AC, Hwang DY, Yung Gee H, Dworschak GC, et al. Whole-exome resequencing reveals recessive mutations in TRAP1 in individuals with CAKUT and VACTERL association. Kidney Int 2014; 85 (6): 1310–1317.
67. Kohl S, Hwang DY, Dworschak GC, Hilger AC, Saisawat P, Vivante A, et al. Mild recessive mutations in six Fraser syndrome-related genes cause isolated congenital anomalies of the kidney and urinary tract. J Am Soc Nephrol 2014; 25 (9): 1917–1922.
| Прикрепленный файл | Размер |
| 595.68 кб |
‹ Гангрена Фурнье: современные подходы к лечению (обзор литературы) Вверх Клинико-экономическое обоснование стратегии определения PCA3 в моче при диагностике рака предстательной железы ›
Особенности протекания гломерулонефрита
Острый, подострый, хронический гломерулонефрит может стать последствием перенесенных воспалений:
- стрептококковых инфекций;
- ангины;
- рожи;
- скарлатины.
Проявиться осложнение может уже буквально через несколько дней: ребенок становится вялым, жалуется на головные боль и неприятные ощущения в животе.
Часто наблюдаются:
- рвота;
- тошнота;
- отекает личико, затем ножки;
- моча приобретает красный цвет.
Малышу назначают диету – продукты без соли, ограничение потребления жидкости, зато больше овощей, мучных изделий. Проводят антибактериальную терапию, назначают витамины.
Лечение нужно начать скорее, иначе есть риск проявления острой почечной недостаточности, при которой почки отказывают, происходит интоксикация организма.
Из острой формы может развиться подострая, характеризующаяся быстрым развитием хронической почечной недостаточности. Необходимо срочно начать терапию, иначе прогнозы неблагоприятные. Могут помочь гемодиализ, диета и та же терапия, что при острой форме.
Хронический гломерулонефрит чаще встречается у малышей до пяти лет в нефротической форме.
Признаками заболевания почек являются:
- отечность;
- моча с кровью;
- снижение уровня белка в крови;
- повышение уровня белка в моче;
- побледнение кожных покровов, их охлаждение;
- сухость во рту;
- одышка, кашель.
Периоды ремиссии чередуются с периодами обострения: симптомы стихают, а затем проявляются вновь.
Лечение и симптомы воспаления почек у женщин
21 Март, 2020 Vrach
Воспаление почек (нефрит) в урологии встречается достаточно часто. Спровоцировать патологию на активность могут различные факторы, но, как только начинают проявляться симптомы воспаления почек у женщин, необходимо срочно обращаться в медицинское учреждение. Нефрит представлен в виде воспалительного процесса почек, который стремительно поражает клубочковый аппарат в организме женщины.
Воспалительный процесс подразделяется на 2 подвида: очаговый (активизируется на нескольких участках внутреннего органа) и диффузный (инфекционно-воспалительная патология поражает обе почки). Медики отмечают, что большую опасность для женского организма представляет диффузное воспаление почек. В данном случае воспалительный процесс поражает все ткани внутреннего органа, что при несоблюдении адекватного лечения может преобразоваться в различные осложнения.
Классификация
Медицинская статистика указывает, что воспалению почек больше подвержена женская половина населения. Первопричины появления патологии могут быть различными, сам же воспалительный процесс классифицируется следующими разновидностями:
- Нефрит в интерстициальной форме — поражаются канальцы внутреннего органа.
- Шунтовый нефрит — воспалительным процессом поражается иммунная система.
- Пиелонефрит — воспаление развивается из-за активности вредоносных бактерий.
- Гломерулонефрит — воспаление развивается по причине поражения внутреннего органа вирусов гломерул.
Причины воспаления почек у женщин
Как правило, патологическая инфекция в организме женщины распространяется из нижних мочевыводящих путей. Болезнетворные бактерии попадают в организм через уретру (появление дискомфорта при мочеиспускании), которая выводит мочу, а затем размножаются и поражают мочевой пузырь, а затем и почки. Бактерии в почки из мочевого пузыря «продвигаются» по мочеточникам.
Вызвать появление воспаления могут и патогенные бактерии (кишечная палочка), которые при активности стремительно поражают почки. Если у женщины наблюдается инфекция в организме, то она может распространиться до почек по крови и вызвать острое воспаление.
Основные причины:
- Врожденная патология развития внутренних органов — уретры, мочевыводящего канала, мочевого пузыря;
- Мочекаменная болезнь;
- Патологии процесса оттока мочи;
- Пожилой возраст;
- Слабость иммунитета по причине таких заболеваний, как СПИД, Злокачественные новообразования, сахарный диабет.
Инфицирование мочевыводящих путей может произойти и по таким причинам, как:
- Вследствие проведения определенных медицинских процедур (при назначении катетера);
- После перенесенной цистоскопии;
- После операции мочевыводящих путей;
- После курса лечения медикаментозными средствами;
- При повреждении спинного мозга.
Вторичное воспаление развиться по следующим причинам:
- Отравление металлами;
- Наличие серьезных патологий в организме — туберкулез, артрит, диабет, сифилис;
- Злоупотребление спиртосодержащими напитками на протяжении длительного времени;
- Поражения кожи и внутренних органов доброкачественными или злокачественными новообразованиями;
- Беременность;
- Грипп, преобразующий за собой появление тяжелых последствий;
- Хронические заболевания почек.
Признаки наличия воспаления
Когда начинается воспалительный процесс, то симптомы патологии проявляются незамедлительно. При ухудшении общего самочувствия важно срочно обратиться в медицинское учреждением. Заниматься самолечением очень опасно, это может негативно сказаться и на общем здоровье, и на жизни женщины.
Какие симптомы являются основными?
- Резкое повышение температуры до предела в 38 и больше градусов;
- Появление острых и тянущих болей в области поясницы, спины, паховой области и внизу живота;
- Болезненность при мочеиспускании;
- В моче появляются осадочные явления в виде хлопьев, нередко в моче образуются и вкрапления крови или гноя;
- «Ложные» позывы к мочеиспусканию;
- Появление в моче «тухлого» запаха.
Вторичные признаки:
- Повышенное потоотделение;
- Озноб или лихорадка;
- Тошнота, нередко и рвота;
- Общая слабость, быстрая утомляемость;
- «Липкая» кожа;
- Помутнение сознания (у пожилых людей);
- Отечность нижних конечностей, лица;
- Нарушение нормальной работоспособности пищеварительного тракта (метеоризм, диарея или же запор);
- Жажда;
- Ощущение сухости во рту.
Если происходит игнорирование симптомов и причин, то патология провоцирует развитие таких осложнений, как — появление судорог, онемение кожного покрова, боль в мышцах. Тяжелыми последствиями воспалительного процесса почек является развитие гидроторакса или гидроперикарда.
Основа лечения
Лечение необходимо начинать незамедлительно после проявления начальных болезненных симптомов. На ранней стадии патологию вылечить можно быстро и без использования сильных медикаментозных средств. В запущенном виде патология способна «обрасти» и сопутствующими заболеваниями, в этом случае пациентке потребуется усиленная терапия.
Чтобы подобрать нужную схему терапии, важно определить тип и определить первопричину появления патологии.
Первое, что используется в качестве лечения, это устранение причины, провоцирующей появление воспаления внутреннего органа. Если женщина находится в тяжелом состоянии, то лечение проводится в стационаре. В иных случаях допускается терапия на дому, но с четким соблюдением медицинских требований.
В схему медикаментозного лечения включено назначение следующих препаратов:
- Диуретики;
- Антибиотики;
- Гипотензивные средства;
- Препараты кальция;
- Медикаменты, стабилизирующие кровообращение, а также питание в почечных тканях;
- Цитостатики;
- Антигистаминные препараты;
- Иммуномодуляторы;
- Глюкокортикостероиды;
- Витамины подгруппы В, а также витамины Р и С.
Все лекарства назначаются доктором в индивидуальном порядке.
Лечебная диета
Соблюдение лечебной диеты при проведении терапии поможет быстро и без негативных последствий устранить недуг. Основа диеты — это снижение нагрузки на внутренний пораженный орган. В рацион пациентки должны входить свежие овощи, а также фрукты, злаковые крупы, отрубной хлеб. Диетологи рекомендуют строго ограничить потребление мясных и молочных продуктов, а также соли.
Если женщина страдает гипертонией, то ей рекомендовано употреблять меньшее количество жидкости. В ином случае, важно соблюдать требуемый ежедневный питьевой режим (по 2 литра). Вместо питьевой воды можно пить отвары лекарственных трав (березовые почки, хвощ, можжевельник, кукурузные рыльца, толокнянка, шалфей) или морсы из клюквы или брусники, такие напитки помогают снять воспалительный процесс в организме и обладают активным мочегонным свойством.
Причины возникновения пиелонефрита
Пиелонефритом – острым либо хроническим – называют воспаление почечных лоханок. Возникает воспаление почек у ребенка на фоне заражения почек патогенными бактериями – стафилококками, кишечной палочкой, протеем. Бактерии проникают в почки через кровь (характерно для грудничков с первых дней жизни), через мочевыводящие пути либо лимфатические сосуды.
Мочеполовой путь характерен для деток более старшего возраста, причем девочки болеют пиелонефритом чаще, чем мальчики, что обусловлено разницей в строении мочеполовой системы – у девочек мочеиспускательный канал короче, чем у мальчиков, поэтому бактерии быстрее проникают по нему в почки.
Тяжелее всего протекает воспаление почек у детей грудничков. Наблюдаются:
- высокая – до 400 – температура тела;
- рвота – налицо интоксикация;
- ножки крохи подгибаются, головка запрокидывается назад;
- кожа малыша желтеет;
- происходит обезвоживание;
- малыш беспокоен – мочеиспускание вызывает сильнейшие боли.
У деток постарше проявляются частые позывы к мочеиспусканию, жжение при этом процессе, боли в пояснице.
Лечение подразумевает покой, лучше – постельный режим, бессолевую диету, прием антибиотиков, обильное питье.
При хроническом пиелонефрите обычно поражаются обе почки, в период обострения наблюдаются:
- болезненность и учащение мочеиспускания;
- лихорадочные состояния;
- боли, отдающие в поясницу;
- сильные головные боли.
Лечение обычно прописывается то же, что и при острой форме пиелонефрита.
СИНДРОМ ШАФЕРА
Этиология и патогенез. Этот синдром очень напоминает семейную нефропатию с глухотой (синдром Альпорта). Он описан Шафером в 1962 г. У пораженных болезнью лиц обнаруживают высокое содержание пролина в крови, а в отдельных случаях дефект энзимов — недостаточность пролиноксидазы в печени. Синдром передается по наследству аутосомно-рецессивно.
Клиника. Одним из основных признаков болезни является микрогематурия. Глухота нервного происхождения наблюдается у отдельных больных. У некоторых детей отмечаются судороги провонированные светом В таких случаях электроэенцефа гографически выявляется повышеная чувствительность к свету Другим важным симптомом является отставание в умственном развитии — изолированное или в сочетании с другими признаками
До сих пор данных о результативном лечении нет Прогноз неблагоприятный
Особенности инфекционного нефротического синдрома
Патология представляет собой токсическое поражение почек, причиной которого являются внутриутробные инфекции, родовая асфиксия.
Начинается болезнь:
- со снижения аппетита у ребенка;
- он становится вялым, раздражительным;
- кожа бледнеет;
- появляются отеки;
- возникает неприятный привкус, сухость во рту;
- ребенка тошнит, рвет;
- наблюдаются вздутие живота, диарея.
Лечение нужно начинать как можно скорее – правильную терапию и диету назначит врач – диуретики, витамины, Преднизолон и иные препараты ускорят выздоровление.
НАСЛЕДСТВЕННЫЙ НЕФРОЗ
Наследственный нефроз редкое заболевание наступающее вскоре после рождения ребенка или в груд ном возрасте Заболевание носит наследственный характер прогноз — плохой
Этиология и патогенез. Впервые болезнь была описана в 1942 г, но наиболее подробное изучение принадлежит Hallman. Предполагают что болезнь наследуется аутосомно рецессивным путем. Примерно у одной трети семей с этим заболеванием установлены родственные браки Число заболевших детей одного рода может достигать 3-4. Имеются также случаи заболевания восьми детей — четырех пар гомозиготных близнецов. Обычно мать не болеет нефропатией но нередко беременность протекает с токсикозом. Большая часть описанных случаев заболеваний из скандинавских стран преимущественно из Финляндии (Hallman). Предполагают что наследственный нефроз связан или с врожденным пороком развития почек или же с врожденным нарушением синтеза белков. Hallman обнаружил наличие антипочечных антител в крови больного новорожденного ребенка и у его матери. Существует возможность иммунизации матери почечными протеинами и перехода антител через плаценту в кровь плода что приводит и его заболеванию еще во время внутриутробного развития. В качестве этиологических факторов допускается и несовместимость по группе крови (Rh-фактор).
Патодотоанатомическая картина болезни раз типична и нетипична Во мнoгиx случаях изменения в почках характеризуются мелким кистозом почек
Клиника. Наследственный нефроз чаше всею развивается еще у новорожденного ребенка или в первые месяцы жизни, в редких случаях — до конца второю года жизни. В большинстве случаев дети рождаются недоношенными, плацента отечная, крупных размеров. У детей рано появляются вторичные изменения костей — широкие швы черепа, замедление процесса оссификации. Масса тела и рост ребенка могут значительно отставать от нормы.
Типичными признаками являются отеки, общая вялость и бледность кожных покровов. Значительные изменения наступают и в сывороточных протеинах, низкий уровень общего белка, высокая гипоальбуминемия. Уровни общих липидов и холестерола в сыворотке крови повышенные Протеинурия — значительная. Диагнозу способствуют результаты биопсии почки
Наследственный нефроз характеризуется быстрым npoгрессирующим развитием. Многие дети умиpaют еще в первые несколько месяцев на первом году жизни
Лечение. Проводимое до сею времени лечение кортикостероидами не дало результатов, за исключением больных с минимальными поражениями почек. Показаны диуретические препараты, подходящая диета богатая белками. При появлении врожденною нефроза в семье рекомендуется обратиться в генетическую консультацию во избежании повторения заболевания.